题目内容
9.为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量.Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1
(1)若用4.48LCH4还原NO生成N2,则放出的热量为119.88kJ.(气体体积已折算为标准状况下)
(2)NOx可用强碱溶液吸收产生硝酸盐.在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4
溶液作用生成棕色物质,这是检验NO3-的特征反应.写出该过程中产生NO的离子方程式:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
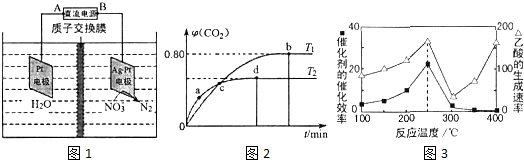
电解的原理如图1所示,则:
(3)电解时阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O;当电路中转移20mol电子时,交换膜左侧溶液质量减少180g.
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s).不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示.请回答:
(4)T1时,该反应的化学平衡常数的数值为1024.
(5)下列说法不正确的是BD(填字母).
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)?CH3COOH(g)△H<0直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示.
(6)①250-300℃时,乙酸的生成速率减小的主要原因是温度超过250℃时,催化剂的催化效率降低.
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
分析 (1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1
由盖斯定律②×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),根据盖斯定律计算得到反应的焓变,热化学方程式的意义:1molCH4还原NO生成N2,则放出的热量值等于焓变值;
(2)酸性条件下,亚铁离子和硝酸根离子反应生成铁离子、一氧化氮和水;
(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,Pt电极为阳极,在电解池的阴极上发生得电子的还原反应,根据电极反应式结合电子守恒来计算;
(4)根据b点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T1时化学平衡常数K;
(5)A、因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.反应前后气体体积不变,压强变化对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
(6)①根据温度对催化剂活性的影响分析;
②根据温度对化学平衡移动的影响分析.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-586.7kJ•mol-1
由盖斯定律②×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),所以焓变△H=(-586.7kJ•mol-1)×2-(-574kJ•mol-1)=-599.4kJ•mol-1,若用4.48L即0.2molCH4还原NO生成N2,则放出的热量为599.4kJ/mol×0.2mol=119.88kJ,
故答案为:119.88;
(2)酸性条件下,亚铁离子和硝酸根离子反应生成铁离子、一氧化氮和水,离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,阴极上电极反应式为2NO3-+12H++10e-=N2↑+6H2O,Pt电极为阳极,阳极反应为2H2O-4e-=O2+4H+,当转移20mol电子时,阳极消耗10mol水,产生20molH+进入阴极室,阳极质量减少180g,
故答案为:2NO3-+12H++10e-=N2↑+6H2O;180;
(4)T1时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{4}$=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1,
T1时化学平衡常数K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$=$\frac{1.{6}^{5}}{0.{4}^{5}}$=1024,
故答案为:1024;
(5)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不等,故B错误;
C.反应前后气体体积不变,压强变化对平衡无影响,CO的转化率不变,故C正确;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:BD;
(6)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,是因为250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动,故答案为:250℃时,催化剂的催化效果最好,提高温度耗费较高的能量,并且低温条件有利于平衡向着正反应方向移动.
点评 本题考查热化学反应方程式计算、化学平衡常数的相关计算、化学平衡移动原理,综合性很强,难度较大.


| A. | X可以发生加成反应 | |
| B. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| C. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| D. | 步骤①的反应类型是水解反应 |
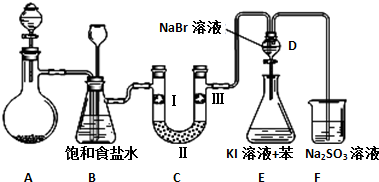
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
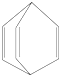
| A. | 桶烯分子中所有原子在同一平面内 | |
| B. | 桶烯在一定条件下能发生加成反应和聚合反应 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯中的一个氢原子被氯原子取代,所得产物只有一种 |
| A. | 两者均属于离子化合物 | |
| B. | 两种化合物中所含有化学键类型相同 | |
| C. | Na3N与盐酸反应可得到2种盐 | |
| D. | Na3N中N3-半径比Na+半径大 |
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |

 .
.