题目内容
18.根据要求的化学用语填写(1)H2O2的电子式为

(2)C2H2的结构式为CH≡CH
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-8896kJ/mol
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为Fe3++e-═Fe2+,负极反应式为Fe-2e-═Fe2+
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构.它的电子式是
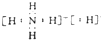 .
.
分析 (1)双氧水属共价化合物,原子之间通过共用电子对成键;
(2)乙炔中的原子是直线型结构,含有碳碳叁键;
(3)根据热化学方程式的书写方法来书写,书写时注意反应热的数值应为1mol甲烷燃烧放出的热量;
(4)铜、铁、氯化铁构成的原电池中,铁易失电子作负极,铜作正极,正极上铁离子得电子发生还原反应;
(5)NH5的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,应为NH4H,为离子化合物,据此书写电子式.
解答 解:(1)双氧水属共价化合物,原子之间通过共用电子对成键,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,
,
故答案为: ;
;
(2)乙炔中的原子是直线型结构,含有碳碳叁键,结构式为CH≡CH,故答案为:CH≡CH;
(3)1.00g甲烷完全燃烧生成液态水时能放出556kJ的热量,16g甲烷(1mol)完全燃烧生成液态水时能放出16×556kJ=8896kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-8896kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-8896kJ/mol;
(4)铜、铁、氯化铁构成的原电池中,铁易失电子作负极,电极反应式为Fe-2e-=Fe2+,铜作正极,正极上铁离子得电子发生还原反应,电极反应式为Fe3++e-═Fe2+,故答案为:Fe3++e-═Fe2+;Fe-2e-═Fe2+;
(5)NH5为离子混合物,分子中存在NH4+和H-,电子式为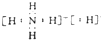 ,故答案为:
,故答案为: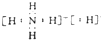 .
.
点评 本题综合考查学生电子式的书写、热化学方程式的书写以及原电池的构成和电极反应式的书写知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
6. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W? | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应水化物为强碱 |
13.下表是元素周期表的一部分,回答下列问题:(请用元素符号或化学式回答)
(1)在这些元素中,与水反应最剧烈的金属元素是Na;元素的气态氢化物最稳定的物质是HF.
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式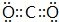 ;
;
(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;
(3)⑤、⑦的最高价氧化物的对应水化物发生反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O
(4)②形成单质的结构式N≡N;①和③形成的酸性氧化物的电子式
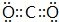 ;
;(5)在这些元素中,原子半径最大的非金属元素的原子是Si.
3.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | H2O2的电子式: | ||
| C. | 硫原子的结构示意图: | D. | 甲烷分子的比例模型: |
10.下列叙述正确的是( )
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| C. | 镀层破损后,镀锡铁片比镀锌铁片更耐腐蚀 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
7.在人类已知的化合物中,种类最多的是( )
| A. | 过渡元素形成的化合物 | B. | ⅢA族元素形成的化合物 | ||
| C. | ⅣA族元素形成的化合物 | D. | ⅦA族元素形成的化合物 |

 如图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液.
如图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液.