题目内容
11.已知3.6g碳在6.4g氧气中燃烧,至反应物全部耗尽,放出X kJ的热量,已知单质碳的燃烧热为Y kJ/mol,则C与O2反应生成CO的热化学方程式为-(5X-0.5Y)kJ/mol.分析 碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.3.6g碳的物质的量为0.3mol,6.4g的氧气的物质的量为0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳的热量,放出的总热量减去生成二氧化碳,放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H.
解答 解:碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
3.6g碳的物质的量为$\frac{3.6g}{12g/mol}$=0.3mol,6.4g的氧气的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,n(C):n(O2)=3:2,
介于2:1与1:1之间,所以上述反应都发生.
令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1.
单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,
所以生成0.2molCO放出的热量为XkJ-0.1YkJ.
由于碳燃烧为放热反应,所以反应热△H的符号为“-”,
故1mol C与O2反应生成CO的反应热△H=-$\frac{XkJ-0.1YkJ}{0.2mol}$=-(5X-0.5Y)kJ/mol.
故答案为:-(5X-0.5Y)kJ/mol.
点评 考查反应热的计算,难度不大,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. |  制取少量氨气 | B. |  可制的金属铁 | ||
| C. |  制乙酸乙酯 | D. |  验证混合气体中一定含有乙烯 |
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 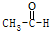 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| C. | 镀层破损后,镀锡铁片比镀锌铁片更耐腐蚀 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
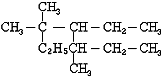 完成下列小题
完成下列小题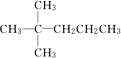 ,
,