题目内容
17.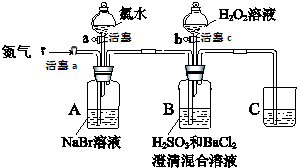 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
分析 探究H2O2、H2SO3、Br2氧化性强弱:H2SO3具有还原性,空气中的氧气和H2SO3在溶液中也会发生反应将其氧化,装置中含有空气,所以通入氮气,先排尽装置内的空气,排除O2对氧化H2SO3实验的干扰,打开活塞b,滴加氯水,关闭活塞b,氯气氧化溴离子为溴单质,A中溶液变为红棕色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,打开活塞a,吹入氮气,A中红棕色明显变浅,发生:Br2+H2SO3+H2O═4H++2Br-+SO42-,B中有气泡,产生大量白色沉淀,SO42-+Ba2+═BaSO4↓说明氧化性:Br2>H2SO3,停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液,过氧化氢在酸溶液中会氧化溴离子为溴单质,H2O2+2Br-+2H+=Br2+2H2O,一段时间后,混合液逐渐变成红棕色,生成溴单质,说明氧化性:H2O2>Br2,打开活塞b,滴加氯水,A中溶液变为红棕色,确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
(1)装置C是尾气吸收装置,反应过程中有氯气、溴蒸气等污染性气体不能排放到空气中需要用氢氧化钠溶液吸收;
(2)由于在装置中含有空气,空气中的氧气和H2SO3在溶液中也会发生反应将其氧化,所以乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,先排尽空气;
(3)亚硫酸被溴蒸气氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀;
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是,过氧化氢浓度小、过氧化氢与溴离子反应慢,亚硫酸有剩余等;
(5)滴入过氧化氢是氧化剂,在酸性溶液中可以把溴离子氧化为溴单质;
(6)物质在发生氧化还原反应中氧化性的强的可以把氧化性弱的制取出来,所以通过上述全部实验,得出结论:氧化性:H2O2>Br2>H2SO3;
(7)氯气氧化溴离子为溴单质,亚硫酸被溴蒸气氧化成硫酸,为排除Cl2对后续实验的干扰进行实验操作Ⅴ.
解答 解:(1)装置C是尾气吸收装置,反应过程中有氯气、溴蒸气等污染性气体不能排放到空气中,氯气、溴蒸气等为酸性气体,需要用氢氧化钠溶液吸收,
故答案为:吸收尾气中的SO2、Br2等,防止污染空气;NaOH溶液;
(2)由于在装置中含有空气,空气中的氧气和SO2在溶液中也会发生反应将其氧化,所以实验操作Ⅰ中,吹入氮气的目的通入N2,排净装置内空气,
故答案为:排尽装置内的空气,排除O2对氧化H2SO3实验的干扰;
(3)打开活塞a,吹入氮气,A中溴蒸气被吹出,红棕色明显变浅,B中发生:Br2+H2SO3+H2O═4H++2Br-+SO42-,硫酸根离子与钡离子反应,SO42-+Ba2+═BaSO4↓,产生大量白色沉淀为硫酸钡沉淀,
故答案为:Br2+H2SO3+H2O═4H++2Br-+SO42-;SO42-+Ba2+═BaSO4↓;
(4)实验操作III,开始时颜色无明显变化的原因是,过氧化氢浓度小、过氧化氢与溴离子反应慢,亚硫酸有剩余等,
故答案为:H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可);
(5)滴入过氧化氢在酸溶液中会氧化溴离子为溴单质,根据电子守恒、原子守恒配平,方程式为:H2O2+2Br-+2H+=Br2+2H2O,
故答案为:H2O2+2Br-+2H+=Br2+2H2O;
(6)物质在发生氧化还原反应中氧化性的强的可以摆氧化性弱的制取出来,即氧化剂的氧化性大于氧化产物,依据反应H2SO3+Br2+H2O=H2SO4+2HBr;H2O2+2Br-+2H+=Br2+2H2O,氧化性由强到弱的顺序为:H2O2>Br2>H2SO3,
故答案为:氧化性:H2O2>Br2>H2SO3;
(7)A中溶液变为红棕色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,氧化性:Cl2>Br2,为确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰,进行实验操作Ⅴ,
故答案为:确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
点评 本题考查了探究H2O2、H2SO3、Br2氧化性强弱有关实验,掌握物质性质的实验验证方法,根据实验现象分析,熟练应用氧化还原反应的强弱规律,正确书写离子方程式是解答的关键,题目难度中等.

| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 过滤操作时,向过滤器中倾倒液体时一定要用玻璃棒引流 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| A. | BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2 | |
| B. | Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2 | |
| C. | Be(OH)2即能溶于盐酸,又能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,BeCl2一定是离子晶体 |
| A. | Na+、Fe2+ | B. | Al3+、SO42- | C. | Fe3+、SO42- | D. | Al3+、Cl- |
| A. | 与足量高锰酸钾酸性溶液反应 | B. | 与足量溴水反应 | ||
| C. | 在一定条件下通入氢气 | D. | 分别进行燃烧 |
| A. | (CH3)3CCH2OH | B. | (CH3CH2)2CHOH | C. | CH3(CH2)3CH2OH | D. | CH3CH2C(CH3)2OH |

