题目内容
6.原电池是把化学能转化为电能的装置.
(1)如图甲所示:①在Cu-Zn原电池中,Zn极发生氧化反应(填“氧化”或“还原”). 写出电极反应式Zn-2e-=Zn2+.
Cu极为正极;电极反应式为2H++2e-=H2↑.
②外电路中,电子流向正极;内电路溶液中,SO42-移向负极.
(2)从理论上讲,氧化还原反应都可以设计成原电池.请你根据以下这个反应:Cu+2FeCl3═CuCl2+2FeCl2,设计一个原电池(如图乙),在图中括号内标明正负极的材料及电解质溶液,写出正极和负极的电极反应式.
负极反应式为Cu-2e-=Cu2+;
正极反应式为2Fe3++2e-=2Fe2+.
分析 (1)原电池中活泼金属做负极;负极上活泼金属失电子发生氧化反应;正极上溶液中的阳离子得电子;原电池中电子从负极流向正极;原电池中阴离子移向原电池的负极;
(2)由方程式可知,Cu被氧化,为原电池的负极,则正极可为碳棒,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:(1)①在Cu-Zn原电池中,活泼金属Zn做负极;负极上Zn失电子发生氧化反应生成锌离子,其电极反应为:Zn-2e-=Zn2+;正极上溶液中的铜离子得电子生成Cu,其电极反应式为:2H++2e-=2H2↑;
故答案为:氧化;Zn-2e-=Zn2+;正; 2H++2e-=2H2↑;
②原电池中电子从负极流向正极,所以外电路中,电子流向正极;原电池中阴离子移向原电池的负极,则内电路溶液中,SO42-移向负极;
故答案为:正;负;
(2)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
Cu被氧化,为原电池的负极,则正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为 ,
,
故答案为: ;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
点评 本题考查了原电池原理及原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液,题目难度中等.

练习册系列答案
相关题目
16.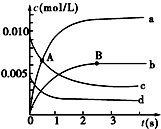 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
17.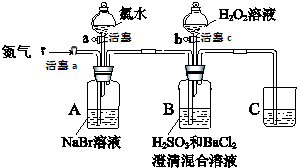 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
实验记录如下:
请回答下列问题:
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
14.下列物质所含的化学键只有离子键的是( )
| A. | Na2O2 | B. | HCl | C. | KOH | D. | CaCl2 |
1.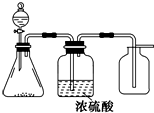 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
11.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与“足球烯”C60; ②D与T ③ 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦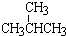 与
与 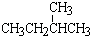 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl
⑨
⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
①金刚石与“足球烯”C60; ②D与T ③
 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦
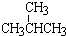 与
与 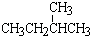 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl⑨

⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
| 各组物质互为 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
| 填写序号 |
18.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol碘化氢(a>b),待反应2HI?I2(g)+H2(g)达平衡后,下列说法肯定正确的是( )
| A. | 从反应开始到建立平衡所需时间:tA<tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.