题目内容
5.某溶液中含大量Fe2+、Al3+、Fe3+、Na+、Cl-、SO42-离子,其中加入足量的Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是( )| A. | Na+、Fe2+ | B. | Al3+、SO42- | C. | Fe3+、SO42- | D. | Al3+、Cl- |
分析 溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,Fe2+氧化成Fe3+,减少的是亚铁离子,增加的是三价铁离子、钠离子、氯离子,铝离子、硫酸根离子保持不变.
解答 解:A、因为Na2O2是强氧化剂,而且遇水生成NaOH,钠离子浓度增大,故A错误;
B、Na2O2是强氧化剂,而且遇水生成NaOH,铝离子能和过量的氢氧化钠反应生成四羟基合铝酸根离子,在盐酸作用下又会生成铝离子,根据铝元素守恒,则铝离子量不变,硫酸根离子自始至终不发生变化,故B正确;
C、因为Na2O2是强氧化剂,而且遇水生成NaOH,于是Fe2+氧化成Fe3+,并沉淀,再和盐酸反应生成三价铁离子,所以三价铁离子浓度增大,故C错误;
D、加入足量的盐酸溶解沉淀,氯离子浓度增大,故D错误.
故选B.
点评 本题考查物质性质的有关知识,可以根据所学知识进行回答,难度不大,注意亚铁离子被氧化为三价铁离子是解题的易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.2006年美俄联合研究小组成功制造出了118号元素,下列说法错误的是( )
| A. | 118号元素应该位于周期表的0族元素氡之下 | |
| B. | 制造出的118号元素的一个原子中子数为179,则该原子的摩尔质量297 | |
| C. | 目前还没有发现117号元素,推测117号元素应该属于金属元素 | |
| D. | 118号原子可衰变成116号元素,该过程不属于化学变化 |
16.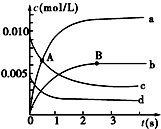 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
13.电子云图中的小黑点表示的意义是( )
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
20.能够用来鉴别NaCl、AlCl3、FeCl2、MgCl2四种溶液的试剂是( )
| A. | NaOH | B. | AgNO3 | C. | 氨水 | D. | 稀硫酸 |
10.下列实验操作、实验现象和实验结论不对应的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气与氯化氢反应 |
| B | 将洁净铁片放入浓硫酸或浓硝酸中 | 无明显变化 | 常温下,浓硫酸、浓硝酸使铁片钝化 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热升华 |
| A. | A | B. | B | C. | C | D. | D |
17.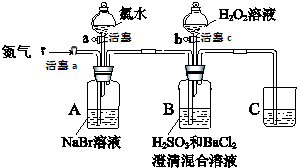 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
实验记录如下:
请回答下列问题:
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
14.下列物质所含的化学键只有离子键的是( )
| A. | Na2O2 | B. | HCl | C. | KOH | D. | CaCl2 |
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.