题目内容
2.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )| A. | 与足量高锰酸钾酸性溶液反应 | B. | 与足量溴水反应 | ||
| C. | 在一定条件下通入氢气 | D. | 分别进行燃烧 |
分析 乙烯中含双键,与溴水、高锰酸钾反应,而乙烷不能;除杂时不能引入新杂质,乙烯与高锰酸钾发生氧化反应生成二氧化碳,据此分析解答.
解答 解:A.乙烯和高锰酸钾溶液反应生成二氧化碳,酸性高锰酸钾溶液能除去乙烷中的乙烯,但又引进新的杂质,故A不选;
B.乙烯和足量溴水反应生成1,2-二溴乙烷,乙烷和溴水不反应,所以可以除去乙烷中的乙烯,故B选;
C.和过量H2混合,引入新杂质氢气,不能除杂,且加成反应现象不明显,不利用此法鉴别,故C不选;
D.二者都易燃,如果分别进行燃烧,不能除去乙烷中的乙烯,故D不选;
故选B.
点评 本题考查物质鉴别和除杂,为高频考点,明确物质性质是解本题关键,利用物质差异性分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2,NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法错误的是( )
| A. | 1 mol Cu2S参加反应时有10 mol电子转移 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 反应中Cu2S作还原剂 | |
| D. | 产物n[Cu(NO3)2]:n[CuSO4]=l:1 |
13.电子云图中的小黑点表示的意义是( )
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
10.下列实验操作、实验现象和实验结论不对应的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气与氯化氢反应 |
| B | 将洁净铁片放入浓硫酸或浓硝酸中 | 无明显变化 | 常温下,浓硫酸、浓硝酸使铁片钝化 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热升华 |
| A. | A | B. | B | C. | C | D. | D |
17.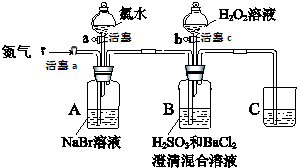 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
实验记录如下:
请回答下列问题:
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
7.为除去括号内杂质,下列有关试剂和操作方法不正确的是( )
| A. | 溴苯(苯):蒸馏 | B. | 乙醇(乙酸):KOH溶液,分液 | ||
| C. | 乙烷(乙烯):溴水,洗气 | D. | 苯(溴):稀NaOH溶液,分液 |
14.下列物质所含的化学键只有离子键的是( )
| A. | Na2O2 | B. | HCl | C. | KOH | D. | CaCl2 |
11.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与“足球烯”C60; ②D与T ③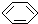 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦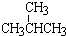 与
与 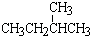 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl
⑨
⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
①金刚石与“足球烯”C60; ②D与T ③
 和
和
④O2与 O3 ⑤淀粉和纤维素 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦
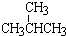 与
与 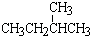 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl⑨

⑩CH2=CH-CH2CH3和CH3-CH=CH-CH3
| 各组物质互为 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
| 填写序号 |
12.现有几个离子反应:
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cr2O72->Cl2>Fe3+ | B. | 氧化性:Cl2>Br2>Cr2O72- | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |