题目内容
12.亚氯酸钠是(NaClO2)一种高效氧化剂、漂白剂.在NaOH溶液中“ClO2与H2O2反应可以得到92%亚氯酸钠.(1)ClO2中氯元素的化合价是+4;在制备亚氯酸钠的反应中ClO2做氧化剂(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2,转移电子物质的量为1mol.
(2)写出该反应的化学方程式为2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2.在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2.还原产物为NaCl,当消耗标准状况下1.12L Cl2 时,制得ClO2 g6.75.
分析 ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2,NaClO2中Cl从+3价升高到+4价,Cl2中Cl元素的化合价从0价降低到-1价,其反应为2NaClO2+Cl2═2ClO2+2NaCl;结合反应物之间的关系计算.
解答 解:ClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高,则反应方程为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O
(1)ClO2中O为-2价,则氯元素的化合价是+4价;Cl元素的化合价降低,被还原,则NaClO2作氧化剂,反应中生成1molNaClO2,转移电子物质的量为1mol;
故答案为:+4;氧化剂;1;
(2)由分析可知,反应的方程式为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
故答案为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
(3)将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2,NaClO2中Cl从+3价升高到+4价,Cl2中Cl元素的化合价从0价降低到-1价,其反应为2NaClO2+Cl2═2ClO2+2NaCl,则还原产物为NaCl,当消耗标准状况下1.12L Cl2,即0.05mol,生成ClO2为0.1mol,其质量为0.1mol×67.5g/mol=6.75g;
故答案为:NaCl;6.75.
点评 本题以氯及其化合物的性质、氧化还原反应,把握习题中的信息及知识迁移应用为解答的关键,侧重氧化还原反应有关的考查,题目难度中等.

 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )| A. | 乙容器中使用了比甲容器更高的温度 | |
| B. | 乙容器中加入了某种不与体系反应的气体,增大了容器内的压强 | |
| C. | 乙容器中使用了催化剂 | |
| D. | 乙容器中可能既升高了温度又使用了催化剂 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制250mL4.6mol/L的稀硫酸需取该浓硫酸62.5mL | |
| C. | 该硫酸浓度太大,不能用于干燥氨气 | |
| D. | 硫酸的摩尔质量为98g |
| A. | NaOH | B. | AgNO3 | C. | 氨水 | D. | 稀硫酸 |
①使用容量瓶前检查是否漏水;②在容量瓶中溶解氢氧化钠固体;
③容量瓶用蒸馏水洗净后残留少量水即使用;④溶液需冷却至室温方可注入容量瓶;⑤加水定容时,不小心超出刻度线,用滴管吸出多余液体.
| A. | ①②③ | B. | ①③④ | C. | ③④⑤ | D. | ①④⑤ |
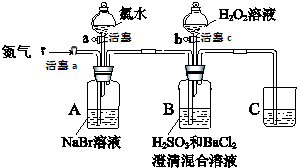 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
| A. |  | B. | 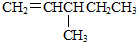 | C. | 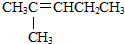 | D. | 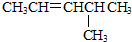 |
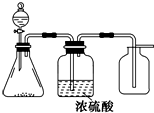 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |