题目内容
7.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
①上述3个装置中,不能证明”铜与浓硝酸反应是吸热反应还是放热反应”的是Ⅲ(填“Ⅰ”“Ⅱ”或“Ⅲ”).
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是左端液面降低,右端液面升高,说明该反应属于放热(填“吸热”或“放热”)反应.
分析 ①装置Ⅰ和Ⅱ都可以分别通过右边装置中液面变化、是否有气泡判断反应是吸热还是放热,而装置Ⅲ是将生成的气体直接通入水中,无法判断该反应是吸热还是放热反应;
②酸碱中和反应为放热反应,反应放出的热使锥形瓶中温度升高,气体体积增大,据此判断U型管中液面的变化.
解答 解:①装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,
故答案为:Ⅲ;
②氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高,
故答案为:左端液柱降低,右端液柱升高;放热.
点评 本题考查化学反应中的热效应,题目难度中等,注意掌握探究反应热效应的常用方法,试题有利于培养学生实验综合分析能力,特别是根据实验现象推理的能力.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
17.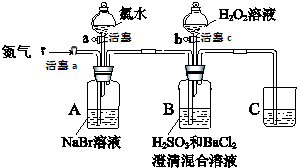 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
实验记录如下:
请回答下列问题:
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
(1)装置C的作用是吸收尾气中的SO2、Br2等,防止污染空气,C中盛放的药品是NaOH溶液.
(2)实验操作Ⅰ中,吹入氮气的目的是排尽装置内的空气,排除O2对氧化H2SO3实验的干扰.
(3)实验操作Ⅲ,B装置中发生反应的离子方程式是Br2+H2SO3+H2O═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓.
(4)实验操作Ⅳ,开始时颜色无明显变化的原因是(写出一条即可):H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可).
(5)实验操作Ⅳ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(6)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
(7)实验操作Ⅴ的目的是确认实验III中吹出的气体中不含Cl2,排除Cl2对后续实验的干扰.
18.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol碘化氢(a>b),待反应2HI?I2(g)+H2(g)达平衡后,下列说法肯定正确的是( )
| A. | 从反应开始到建立平衡所需时间:tA<tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
12.现有几个离子反应:
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cr2O72->Cl2>Fe3+ | B. | 氧化性:Cl2>Br2>Cr2O72- | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
17.等质量的下列物质分别溶于足量水配制成等体积的溶液,其中c(SO42-)最大的是( )
| A. | Na2SO4 | B. | (NH4)2SO4 | C. | Fe2(SO4)3 | D. | Al2(SO4)3 |
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.