题目内容
3.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7.将18.4gA隔绝空气加强热可得到12.8g B和气体单质C.请回答下列问题:(1)A的化学式为S4N4,C的电子式为
 .
.(2)试指出单质C的两点用途保护气;制取氮肥
(3)写出SCl2与氨反应的化学方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl.
(4)亚硝酸钠和X固体在加热条件下可能(填“可能”或“不能”)发生反应,判断理由是NaNO2中N元素化合价为+3价,NH4Cl中N元素化合价为-3价,发生氧化还原反应生成N2.
(5)请设计检验物质X的实验方案:取少量X固体加水溶解,分成两份;其中一份加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+,向另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-.
分析 (1)根据“SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7、A隔绝空气加强热可得到 B和气体单质C”知B是S,A含N、S元素,C是氮气,X是氯化铵.n(A)=$\frac{18.4g}{184g/mol}$=0.1mol,n(S)=$\frac{12.8g}{32g/mol}$=0.4mol,则A中含N:$\frac{(18.4-0.4×32)g}{14g/mol}$=0.4mol,故A的分子式为S4N4;
(2)C为氮气,氮气的作用为:1、保护气,2、制取氮肥,3、合成染料,4、制造炸药等;
(3)SCl2与氨反应生成A和淡黄色单质B及离子化合物X,上述分析判断A为S4N4,B为S,X为氯化铵,根据原子守恒可书写出反应方程式:
(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生归中反应,生成氮气,可以发生反应,
(5)检验氯化铵即检验其中含NH4+和Cl-.
解答 解:(1)根据“SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7、A隔绝空气加强热可得到 B和气体单质C”知B是S,A含N、S元素,C是氮气,X是氯化铵.n(A)=$\frac{18.4g}{184g/mol}$=0.1mol,n(S)=$\frac{12.8g}{32g/mol}$=0.4mol,则A中含N:$\frac{(18.4-0.4×32)g}{14g/mol}$=0.4mol,故A的分子式为S4N4,氮气的电子式为 ,
,
故答案为:S4N4; ;
;
(2)C为氮气,氮气的作用为:1、保护气,2、制取氮肥,3、合成染料,4、制造炸药等,故答案为:保护气;制取氮肥;
(3)SCl2与氨反应生成A和淡黄色单质B及离子化合物X,上述分析判断A为S4N4,B为S,X为氯化铵,根据原子守恒可书写出反应方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生归中反应,生成氮气,可以发生反应,
故答案为:可能;NaNO2中N元素化合价为+3价,NH4Cl中N元素化合价为-3价,发生氧化还原反应生成N2 ;
(5)检验氯化铵即检验其中含NH4+和Cl-.方法是取少量X固体加水溶解,分成两份,其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+,另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子,
故答案为:取少量X固体加水溶解,分成两份,其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+,另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子.
点评 本题考查了物质选择分析,氧化还原反应实质理解应用,离子检验方法,化学式的计算应用,掌握基础是关键,题目难度中等.

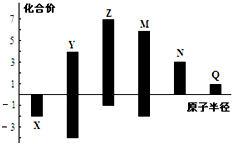 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
| 物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
| Ksp(单位略) | 1.1×10-11 | 2.3×10-3 | 1.8×10-10 | 1.9×10-12 |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将O.001 mol•L-1的AgN03溶液滴入O.001 mol•L-1的KCl和O.001 mol•L-1 的K2CrO4混合溶液中.先产生Ag2Cr04沉淀 | |
| C. | 0.ll mol•L-1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |
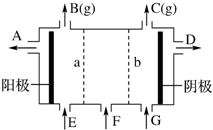 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
