题目内容
12.综合利用海水资源是一个重要的研究课题,下面是工业上用海水制备食盐、纯碱、金属镁等物质的一种流程:
完成下列填空
(1)实验室提纯粗盐的实验操作依次为:取样、溶解、过滤、蒸发(或蒸发结晶).
(2)气体Y是CO2(填化学式),溶液II中发生反应的化学方程式是:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.实验室可用右图装置模拟此制备过程,仪器c的名称干燥管,反应时a管应通入NH3.
(3)写出由MgCl2•6H2O制备无水MgCl2的操作方法在HCl气流中加热.
(4)为了测定碳酸氢钠中杂质氯元素的含量,先称取a g试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用c mol/LAgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂.
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色.
①当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol•L-1,则此时溶液中的c(CrO42-)=2.8×10-3mol•L-1.
②滴定过程中,使用棕色滴定管的原因是防止硝酸银见光分解;当观察到出现砖红色沉淀且在半分钟内不再消失时停止滴定,若此时消耗了AgNO3标准溶液v mL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$.
③下列情况会造成实验测定结果偏低的是c.
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数.
分析 由流程图可知,海水可用于制取纯碱,也可用于制备金属镁,制备纯碱时,海水经蒸发、提纯得到精盐,溶于水在水中先通入氨气,然后通入二氧化碳气体,可生成溶解度较小的碳酸氢钠,经过滤、洗涤和加热和得到碳酸钠固体;
海水中含有氯化镁,加入石灰水,可生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸可生成氯化镁,经蒸发、结晶和脱水后可得氯化镁,电解熔融的氯化镁可得金属镁,
(1)从溶液中获得晶体,可经蒸发、冷却结晶等操作;
(2)制备纯碱,由于氨气易溶于水,而二氧化碳微溶,应在饱和氯化钠溶液中先通入氨气,然后再通入二氧化碳气体,发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)从盐类水解的角度分析;
(4)①根据AgCl的Ksp计算c(Ag+),然后计算c(CrO42;
②滴定时先生成AgCl沉淀,当AgCl全部沉淀时,再生成Ag2CrO4砖红色沉淀且半分钟内不再消失,此时可说明达到滴定终点,根据硝酸银的物质的量计算质量分数;
③a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗,导致硝酸银溶液浓度偏低;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,导致所用体积偏大;
c.滴定前仰视读数,滴定后俯视读数,导致体积偏小.
解答 解:(1)实验室提纯粗盐的实验操作方法为:取样、溶解、过滤、蒸发、冷却结晶等操作,故答案为:过滤;蒸发(或蒸发结晶);
(2)制备纯碱,由于氨气易溶于水,而二氧化碳微溶,应在饱和氯化钠溶液中先通入氨气,然后在通入二氧化碳气体,发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
如用题给图装置制备,由于氨气易溶于水,为防止倒吸,则a通入氨气,仪器c为干燥管,
故答案为:CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;干燥管;NH3;
(3)如果直接在空气中加热MgCl2•6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,故答案为:在HCl气流中加热;
(4)①Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol•L-1,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{2×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L,
则此时溶液中的c(CrO42-)=$\frac{Ksp}{{c}^{2}(A{g}^{+})}$=$\frac{1.12×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=2.8×10-3;
故答案为:2.8×10-3;
②析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L=1.56×10-8mol/L,
Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c({Cr{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L=3×10-5,
则滴定时先生成AgCl沉淀,当AgCl全部沉淀时,再生成Ag2CrO4砖红色沉淀且半分钟内不再消失,此时可说明达到滴定终点,由于硝酸银见光易分解,应放在棕色滴定管内,
若此时消耗了AgNO3标准溶液v mL,则n(AgNO3)=cv×10-3mol,可知n(Cl-)=cv×10-3mol,
因配成100mL溶液,取出20mL注入锥形瓶中,则原样品中含有n(Cl-)=5cv×10-3mol,
则质量分数为$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$,
故答案为:防止硝酸银见光分解;砖红色沉淀且在半分钟内不再消失;$\frac{cv×1{0}^{-3}×5×35.5}{a}×100%$;
③a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗,导致硝酸银溶液浓度偏低,所用体积偏大,则测定及结果偏高,故a错误;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,导致所用体积偏大,则测定及结果偏高,故b错误;
c.滴定前仰视读数,滴定后俯视读数,导致体积偏小,则测定结果偏小,故c正确.
故答案为:c.
点评 本题主要考查了粗盐的提纯、候氏制碱、海水中提取Mg的原理以及含量的测定,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,难度中等.

| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
| 实验操作及现象 | 现象的解释 | |
| A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
| B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
| C | 往水中加入Na2O2固体,滴入酚酞呈红色,振荡,红色褪去 | 产生了碱性物质,且Na2O2具有漂白性 |
| D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
 .
.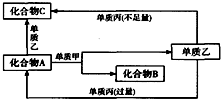 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).