题目内容
14. X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
分析 X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,M的化合价为+6、-2价,故M为S元素;Z的最高正价为+7价、最低价-1,则Z为Cl元素;Y的化合价为+4、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素,据此解答.
解答 解:X、Y、Z、M、N、Q皆为短周期主族元素,由图中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,M的化合价为+6、-2价,故M为S元素;Z的最高正价为+7价、最低价-1,则Z为Cl元素;Y的化合价为+4、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q的化合价为+1价,处于IA族,原子半径大于Al元素,故Q为Na元素.
A.同周期自左而右金属性减弱,故金属性Na>Al,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性高氯酸>硫酸>偏铝酸,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故C错误;
D.原子序数:Z(Cl)>M(S)>X(O)>Y(C),故D错误,
故选B.
点评 本题考查结构性质与位置关系等,难度不大,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
2.下列电解质溶液的有关叙述正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |
4.生活处处有化学.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
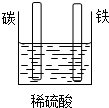
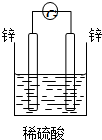
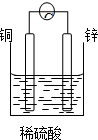
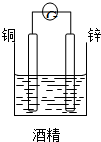
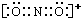 、基态Z原子的价层电子排布图
、基态Z原子的价层电子排布图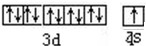 .从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光
.从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光
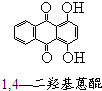 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(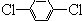 )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).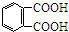 .
.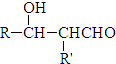 $\stackrel{△}{→}$
$\stackrel{△}{→}$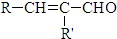
 .
. .
.
 .
.