题目内容
8.下列表示物质结构的化学用语或模型正确的是( )| A. | CH4分子的比例模型: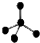 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
分析 A. 为甲烷的球棍模型,不是比例模型;
为甲烷的球棍模型,不是比例模型;
B.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
C.氨气中含有3个氮氢键,氮原子最外层达到8电子稳定结构;
D.二氧化碳为直线型结构,分子中含有两个碳氧双键.
解答 解:A.甲烷为正面体结构,由原子相对大小表示空间结构为比例模型,则CH4分子的比例模型为 ,故A错误;
,故A错误;
B.氯原子的最外层电数为7,其正确的原子结构示意图为: ,故B错误;
,故B错误;
C.氨气的电子式中漏掉了氮原子的一对未成键电子对,氨气正确的电子式为 ,故C错误;
,故C错误;
D.二氧化碳分子中含有两个碳氧双键,其结构式为:O=C=O,故D正确;
故选D.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及电子式、原子结构示意图、比例模型、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
13.A、B、C、D、E为短周期元素,在周期表中所处的位置如图所示.A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
(1)写出三种元素名称A氮、B硫、C氟.
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为 .
.
| A | C | |
| D | B | E |
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为
 .
.
20.下列有关说法合理的是( )
| A. | 根据分散系是否有丁达尔现象,将分散系分为胶体、浊液和溶液 | |
| B. | 用盐酸可以清洗长期存放过FeCl3溶液的试剂瓶 | |
| C. | 二氧化硅广泛用于制作计算机芯片和光导纤维 | |
| D. | 电解精炼铜时,阳极泥中含有Fe、Ag、Au等金属 |
17.合金是一类用途广泛的金属材料,下列关于合金的说法正确的是( )
| A. | 钢是铁的一种合金 | |
| B. | 通常合金的硬度比不上纯净的金属 | |
| C. | 合金是两种金属熔合而成的具有金属特性的物质 | |
| D. | 一般地说合金的熔点比它的各成分金属的熔点都高 |
18.元素周期表中某ⅠA族元素原子序数为x,则同一周期的ⅢA族元素原子序数不可能为( )
| A. | x+25 | B. | x+2 | C. | x+12 | D. | x+26 |