题目内容
13.“溶质的质量分数”和“溶质的物质的量浓度”都是用来表示溶液组成的物理量.“质量摩尔浓度”也是一种表示溶液组成的物理量,它的含义是:用单位质量的溶剂中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的质量摩尔浓度 单位为 mol•kg -1或 mol•g-1.含NaOH 14%的NaOH的溶液,在20℃时密度为1.153g•cm-3,请回答有关问题;
(1)该溶液中NaOH的物质的量浓度为4.04mol/L;NaOH的质量摩尔浓度为4.075mol/Kg;
(2)将该溶液加热升高温度以后(溶剂的质量保持不变),下列物理量中不发生变化的是D
A.溶液的密度
B.溶液的体积
C.NaOH的物质的量浓度
D.NaOH的质量摩尔浓度
(3)从浓度值的稳定性方面来看,物质的量浓度和质量摩尔浓度相比较,更优越的是质量摩尔浓度;从溶液配制方便性的方面来看,物质的量浓度和质量摩尔浓度相比较更优越的是质量摩尔浓度.
(4)请你在完成对问题“(3)”的回答之后 以“一分为二”的观点 用简短的语言谈一下对几种不同的表示溶液组成方法的观点物质的量浓度会因为温度的改变进而溶剂体积和溶液密度改变,导致数量值与实际存在差异,而质量摩尔浓度却不会因此改变,因为物质的量和相对分子质量是恒定的,所以无论体积或者密度如何发生变化,对数值不会有影响.所以相对来说质量摩尔浓度是有优越性的..
分析 (1)根据c=$\frac{1000ρω}{M}$计算出该氢氧化钠溶液的物质的量浓度;设出溶液质量为1L,计算出氢氧化钠的物质的量及溶液的质量,然后计算出氢氧化钠质量摩尔浓度;
(2)温度升高,溶液体积增大,据此判断溶液的密度、物质的量浓度变化;由于氢氧化钠质量、溶液质量不变,则质量摩尔浓度不变;
(3)物质的量浓度因体积受温度影响而变化,而质量摩尔浓度不受温度影响,配制溶液量取体积的准确性不及质量称量;
(4)温度影响溶液的体积,温度不影响质量、物质的量,相对来说质量摩尔浓度是有优越性.
解答 解:(1)溶质质量分数为14%的NaOH溶液,在20℃的温度下密度为1.153g•cm-3,则该溶液的物质的量浓度为:$\frac{1000×1.153×14%}{40}$mol/L=4.04mol/L;
设溶液体积为1L,则溶液的质量为:1.153g•cm-3×1000mL=1153g,1L溶液中含有4.04mol氢氧化钠,质量为:4.04mol×40g/mol=161.6g,溶剂质量为:1153g-161.6g=991.4g,则该NaOH的质量摩尔浓度为:$\frac{4.04mol}{991.4g}$≈4.075mol/Kg,
故答案为:4.04mol/L;4.075mol/Kg;
(2)A.升高温度后溶液体积增大,溶液质量不变,则溶液的密度减小,故A错误;
B.升高温度后溶液体积增大,故B错误;
C.升高温度后溶液体积增大,则NaOH的物质的量浓度减小,故C错误;
D.温度升高对氢氧化钠的物质的量、溶液质量不影响,所以NaOH的质量摩尔浓度不变,故D正确;
故答案为:D;
(3)物质的量浓度c=$\frac{n}{v}$,物质的量浓度因体积受温度影响而变化,而质量摩尔浓度用单位质量的溶剂中所含溶质B的物质的量来表示,质量、物质的量不受温度影响,所以从浓度值的稳定性方面来看,更优越的是质量摩尔浓度,物质的量浓度配制溶液量取体积的准确性不及质量称量,所以从溶液配制方便性的方面来看,质量摩尔浓度更优越,
故答案为:质量摩尔浓度;质量摩尔浓度;
(4)物质的量浓度会因为温度的改变进而溶剂体积和溶液密度改变,导致数量值与实际存在差异,而质量摩尔浓度却不会因此改变,因为物质的量和相对分子质量是恒定的,所以无论体积或者密度如何发生变化,对数值不会有影响.所以相对来说质量摩尔浓度是有优越性的,
故答案为:物质的量浓度会因为温度的改变进而溶剂体积和溶液密度改变,导致数量值与实际存在差异,而质量摩尔浓度却不会因此改变,因为物质的量和相对分子质量是恒定的,所以无论体积或者密度如何发生变化,对数值不会有影响.所以相对来说质量摩尔浓度是有优越性的.
点评 本题考查了物质的量浓度、物质的量的计算,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,注意明确溶质物质的量浓度、质量摩尔浓度的概念为解答关键.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | NH3和N2 | B. | H2O2和NH4Cl | C. | CO2和PCl3 | D. | H2S和Na2O2 |
| A. | 阳离子和阴离子数目一定相等 | |
| B. | 阳离子带的正电荷总数一定等于阴离子所带的负电荷总数 | |
| C. | 除阴、阳离子外溶液中不会再有其它粒子 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液 |
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
| A. | 气体的体积和体系的压强 | B. | 溶液颜色的深浅 | ||
| C. | 固体物质的体积 | D. | H+浓度的变化 |

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
| A. | CH4分子的比例模型: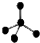 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |