题目内容
19.某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和如图所示的实验装置进行实验.已知:Na2SO3$\stackrel{开始分解>600℃}{→}$Na2S+Na2S4(反应未配平).请回答下列问题: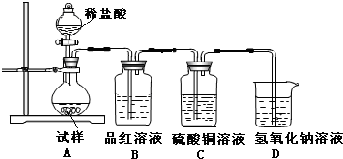
Ⅰ、若某种固体物质受热发生了分解,下列说法正确的是C.
A.一定是氧化还原反应 B.反应后一定有气体生成
C.一定有多种物质生成 D.一定是吸热反应
Ⅱ、(1)在该实验中,如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为先逐渐增大,后逐渐减小.
(2)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O;此时在B、C两装置中可能观察到的现象为B中品红溶液褪色,C中无明显变化.
(3)为检验分解产物中生成的SO42-离子,其操作方法、现象和结论是先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若物明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在.
(4)取上述受热后的固体试样进行分析,测得其中含硫元素的质量分数为25.39%,通过计算知该产物中氧元素的质量分数为38.09%.
分析 Ⅰ、分解反应一定生成多种物质,不一定是氧化还原反应,不一定有气体生成,不一定吸热;
Ⅱ、(1)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3,向所得固体试样中缓缓滴加稀盐酸至足量,首先HCl与SO32-反应生成HSO3-,加到一定程度时,SO32-已完全转化为HSO3-,再加盐酸,HSO3-与HCl反应生成SO2;
(2)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和未分解的亚硫酸钠,SO32-、S2-可在酸性条件下转化为单质硫;SO32-可在酸性条件下转化为SO2,据此解答;
(3)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰;
(4)根据原子守恒可知受热后的固体试样中硫元素和氧元素的质量之比为32:(16×3)=2:3,从而求出氧元素的质量分数为.
解答 解:Ⅰ、某种固体物质受热发生了分解,一定生成多种物质,不一定是氧化还原反应,不一定有气体生成,不一定吸热,故选C;
Ⅱ、(1)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3,向所得固体试样中缓缓滴加稀盐酸至足量,首先HCl与SO32-反应生成HSO3-,加到一定程度时,SO32-已完全转化为HSO3-,再加盐酸,HSO3-与HCl反应生成SO2,所以HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零;
故答案为:先逐渐增大,后逐渐减小;
(2)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化;
(3)要检验硫酸根离子的存在,先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若物明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
故答案为:先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若物明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
(4)受热后的固体试样中硫元素和氧元素的质量之比为32:(16×3)=2:3,硫元素的质量分数为25.39%,则氧元素的质量分数为$\frac{25.39%}{2}×3$=38.09%;
故答案为:38.09%;
点评 本题主要考查性质实验方案的设计,把握硫及其化合物性质是解题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NH3和N2 | B. | H2O2和NH4Cl | C. | CO2和PCl3 | D. | H2S和Na2O2 |
| A. | 气体的体积和体系的压强 | B. | 溶液颜色的深浅 | ||
| C. | 固体物质的体积 | D. | H+浓度的变化 |

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
| A. | 乙醇在铜作催化剂的条件下加热和空气反应得乙醛 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在浓硫酸作用下,乙醇和乙酸共热的反应 | |
| D. | 在浓硫酸作用下.苯在55℃左右与浓硝酸的反应 |
| A. | CH4分子的比例模型: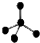 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.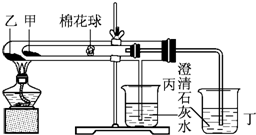 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题: 有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.