题目内容
13.A、B、C、D、E为短周期元素,在周期表中所处的位置如图所示.A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:| A | C | |
| D | B | E |
(2)B元素位于元素周期表中第三周期,ⅥA族.
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示)HClO4;
(4)C原子结构示意图为
 .
.
分析 A、B、C、D、E为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B、D、E处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素、D为P元素、E为Cl,据此解答.
解答 解:A、B、C、D、E为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B、D、E处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素、D为P元素、E为Cl.
(1)由上述分析可知,A为氮、B为硫、C为氟,故答案为:氮;硫;氟;
(2)B为S元素,位于元素周期表中第三周期ⅥA族,故答案为:三、ⅥA;
(3)非金属性Cl>S>P,故三种元素的最高价氧化物的水化物酸性最强的是:HClO4,故答案为:HClO4;
(4)C为F元素,原子结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意理解同主族元素原子序数关系.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
4.下列化学变化属于加成反应的是( )
| A. | 乙醇在铜作催化剂的条件下加热和空气反应得乙醛 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在浓硫酸作用下,乙醇和乙酸共热的反应 | |
| D. | 在浓硫酸作用下.苯在55℃左右与浓硝酸的反应 |
1.根据下列各反应现象所归纳的元素性质不正确的是( )
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
8.下列表示物质结构的化学用语或模型正确的是( )
| A. | CH4分子的比例模型: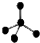 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
18.下列反应中,能用离子方程式H++OH-═H2O表示的是( )
| A. | Ba(OH)2溶液与稀H2SO4 | B. | NaOH溶液与醋酸 | ||
| C. | Fe(OH)3溶液与稀H2SO4 | D. | Ba(OH)2溶液与稀HNO3 |
3.已知R、W、X、Y、Z是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,R原子的最外层电子数是电子层数的3倍,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中不正确的是( )
| A. | 气态氢化物稳定性最强的是HW | |
| B. | PH相同HW和HZ溶液,稀释100倍,前者c(H+)<后者C(H+) | |
| C. | R和X形成简单离子的核外电子排布相同,两者能形成离子键 | |
| D. | 原子半径由小到大的顺序为:rW<rR<rY |