题目内容
16.现有浓度各为2mol/L的FeCl3、FeCl2、CuCl2混合溶液100mL,加入一定量的铁粉,按下列情况填空.(1)充分反应后,无固体存在,则溶液中一定含有的金属阳离子是Cu2+和Fe2+.
(2)反应完毕后,铁粉有剩余,过滤所得的固体物质为Cu和Fe,溶液中一定含有的金属离子的物质的量为0.7mol.
(3)反应完毕,有固体剩余,则反应后的溶液中一定有的金属阳离子为Fe2+,其物质的量取值范围是0.5 mol<n(Fe2+)≤0.7 mol.
分析 (1)根据离子氧化性Fe3+>Cu2+>Fe2+,铁首先与铁离子反应生成亚铁离子,且无固体存在,说明溶液的铜离子没参加反应,所以溶液中一定存在Cu2+和Fe2+;
(2)铁粉有剩余,根据离子氧化性Fe3+>Cu2+>Fe2+,反应的反应方程式为:2FeCl3+Fe═3FeCl2、CuCl2+Fe═Cu+FeCl2,溶液中一定存在亚铁离子,再根据方程式进行相关计算;
(3)当有铜生成,铁粉无剩余,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;如果只有Fe2+,则其物质的量为:0.7mol,如果还有Cu2+,且最多为0.2mol时,只发生2FeCl3+Fe=3FeCl2,则Fe2+物质的量为0.5mol,由于两个反应都发生,所以Cu2+小于0.2mol,因此Fe2+物质的量大于0.5mol,故Fe2+物质的量为:0.5mol<n(Fe2+)≤0.7mol.
解答 解:(2)根据离子氧化性Fe3+>Cu2+>Fe2+,铁首先与铁离子反应生成亚铁离子,且无固体存在,说明溶液的铜离子没参加反应,所以溶液中一定存在Cu2+和Fe2+,故答案为:Cu2+和Fe2+;
(2)由于铁粉有剩余,且氧化性Fe3+>Cu2+>Fe2+,所以溶液中Cu2+和Fe3+完全与铁粉反应,所以过滤所得的固体物质为Cu和Fe;发生反应的方程式为:2FeCl3+Fe═3FeCl2、CuCl2+Fe═Cu+FeCl2,反应后溶液中只存在Fe2+,没有Fe3+、Cu2+,根据氯离子守恒:n(Cl-)=(2mol/L×3+2mol/L×2+2mol/L×2)×0.1L=1.4mol,所以n(Fe2+)=$\frac{1}{2}$n(Cl-)=0.7mol,故答案为:Cu和Fe;0.7;
(3)当有铜生成,铁粉无剩余,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;如果只有Fe2+,则其物质的量为:0.7mol,如果还有Cu2+,且最多为0.2mol时,只发生2FeCl3+Fe=3FeCl2,则Fe2+物质的量为0.5mol,由于两个反应都发生,所以Cu2+小于0.2mol,因此Fe2+物质的量大于0.5mol,故Fe2+物质的量为:0.5mol<n(Fe2+)≤0.7mol,故答案为:Fe2+;0.5 mol<n(Fe2+)≤0.7 mol.
点评 本题考查了Fe与Fe3+、Cu2+的反应,能正确判断固体的成分是解本题的关键,根据固体的成分了解反应的先后顺序,从而确定溶液的成分.

 名校课堂系列答案
名校课堂系列答案| A. | 阳离子和阴离子数目一定相等 | |
| B. | 阳离子带的正电荷总数一定等于阴离子所带的负电荷总数 | |
| C. | 除阴、阳离子外溶液中不会再有其它粒子 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液 |

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
| A. | 乙醇在铜作催化剂的条件下加热和空气反应得乙醛 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在浓硫酸作用下,乙醇和乙酸共热的反应 | |
| D. | 在浓硫酸作用下.苯在55℃左右与浓硝酸的反应 |
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
| A. | CH4分子的比例模型: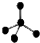 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
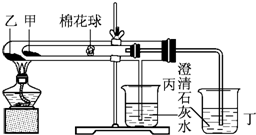 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
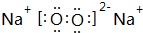 ,指出该化合物中的化学键离子键、非极性共价键.
,指出该化合物中的化学键离子键、非极性共价键. (6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: