题目内容
18.元素周期表中某ⅠA族元素原子序数为x,则同一周期的ⅢA族元素原子序数不可能为( )| A. | x+25 | B. | x+2 | C. | x+12 | D. | x+26 |
分析 同周期的IA族元素、ⅢA族元素,若在短周期,中间相隔1列,在长周期中,中间相隔11个纵行,注意在六、七周期第3列中分别存在镧系和锕系,各有15种元素,以此来解答.
解答 解:元素周期表中同一周期的第IA族和第ⅢA族的两种元素,IA族的原子序数为x,
若在短周期,中间相隔1列,二者原子序数相差2,则ⅢA族元素的原子序数为x+2;
若元素在四、五周期,中间相隔11个纵行,二者原子序数相差12,ⅢA族元素的原子序数为x+12;
若元素在六、七周期,中间有11个纵行,且存在镧系和锕系(各有15种元素),IA族元素、ⅢA族元素的原子序数相差26,即ⅢA族元素的原子序数为x+26,
故选A.
点评 本题考查元素周期表结构,难度不大,注意掌握周期表中列与族的关系,注意镧系元素、锕系元素位置.

练习册系列答案
相关题目
8.下列表示物质结构的化学用语或模型正确的是( )
| A. | CH4分子的比例模型: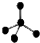 | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
13.设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 标准状况下,9克H2O 含有的分子数为0.5NA | |
| C. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| D. | 1mol Fe和足量稀盐酸反应,铁失去的电子数为2NA |
3.已知R、W、X、Y、Z是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,R原子的最外层电子数是电子层数的3倍,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中不正确的是( )
| A. | 气态氢化物稳定性最强的是HW | |
| B. | PH相同HW和HZ溶液,稀释100倍,前者c(H+)<后者C(H+) | |
| C. | R和X形成简单离子的核外电子排布相同,两者能形成离子键 | |
| D. | 原子半径由小到大的顺序为:rW<rR<rY |
10.下列说法正确的是( )
| A. | 实验室制氯气,是在加热条件下,二氧化锰固体与稀盐酸反应 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 随着氯元素化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强的氧化性 |
7.用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积为1:4的稀盐酸,密度为ρ2g/cm3,则所配制的稀盐酸的物质的量浓度为( )
| A. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{{ρ_1}+4}}$mol/L | B. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{36.5({ρ_1}+4)}}$mol/L | ||
| C. | $\frac{{1000{ρ_1}}}{182.5}$mol/L | D. | $\frac{{1000{ρ_1}{ρ_2}ω}}{182.5}$mol/L |
8.下列说法正确的是( )
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
 有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
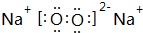 ,指出该化合物中的化学键离子键、非极性共价键.
,指出该化合物中的化学键离子键、非极性共价键. (6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: