题目内容
20.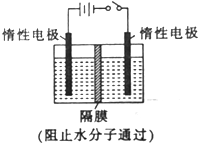 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.①已知两室加入的试剂分别是a.硝酸溶液;b.N2O4+无水硝酸,则左室加入的试剂应为b(填“a”或“b”),其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
分析 由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成,即左室为阳极,右室为阴极.
解答 解:装置图中与电源正极相连的电极为阳极,与电源负极相连的电极为阴极,从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故生成N2O5的左室为阳极,右室为阴极,生成N2O5的反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:b;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题考查了电解原理等知识点,是主要是氧化还原反应实质和电极反应书写,题目难度中等.

练习册系列答案
相关题目
10.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
11. 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | b点对应的溶液:K+、Cl-、SCN-、MnO4- | |
| C. | c点对应的溶液:K+、Fe2+、Br-、NO3- | |
| D. | d点对应的溶液:Ba2+、HCO3-、Cl-、NO3- |
8.通常状况下能共存,且能用碱石灰干燥的一组气体是( )
| A. | H2,N2,SO2 | B. | H2,N2,O2 | C. | HCl,NO2,NH3 | D. | O2,NO2,NO |
15.为除去粗盐中的少量泥沙和钙离子,镁离子,硫酸根等杂质离子,先将粗盐溶于水,过滤,然后对铝业进行四项操作 ①过滤 ②加适量盐酸 ③加过量氢氧化钠和碳酸钠混合溶液 ④加入过量氯化钡溶液.上述操作正确顺序为( )
| A. | ②①③④ | B. | ②③④① | C. | ④②③① | D. | ④③①② |
5.亚磷酸(H3PO3)是二元弱酸,且具有较强还原性.下列说法正确的是( )
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
12.可逆反应CO(g)+H2O(g)$\stackrel{△}{?}$ CO2(g)+H2(g),达到平衡后,有关化学反应限度的说法正确的是( )
| A. | V正=0 | B. | V逆=0 | C. | V正=V逆≠0 | D. | V正=V逆=0 |
 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.