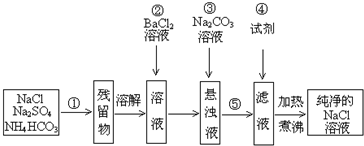
题目内容
9. 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.(1)Mg、Al、的第一电离能:Mg>A1(填“<”、“>”或“=”);Ti的基态原子的电子排布式为[Ar]3d24s2.
(2)A1Cl3晶体在熔化时,形成Al2Cl6分子,Al2Cl6中Al原子的杂化方式为sp3.Al2Cl6中不存在的化学键是d(填写序号).
a.共价键 b.配位键 c.σ键 d.π键
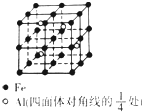
(3)一种Al-Fe合金的立体晶胞如图所示.该晶胞中Al、Fe原子的个数比为1:2.若该晶体的密度为pg•cm-3,则晶胞的边长为$\root{3}{\frac{556}{ρ{N}_{A}}}$cm(用含p、NA的代数式表示,不必化简).
分析 (1)同周期从左到右第一电离能增大,第IIA与IIIA反常;Ti的原子序数为22,位于周期表中的第四周期第ⅣB族;
(2)Al2Cl6的结构为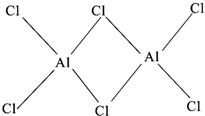 ,每个Al原子含有4个价层电子对;每个Al原子形成3个共价键和一个配位键;
,每个Al原子含有4个价层电子对;每个Al原子形成3个共价键和一个配位键;
(3)根据晶胞的结构图可知,铁原子分布在立方体的体心、顶点、棱边的中点、面心,利用均摊法可知晶胞中含有铁原子数为1+6×$\frac{1}{2}$+12×$\frac{1}{4}$=8,铝原子分布在立方体的体内,数目为4,据此计算;根据密度和晶胞的质量可以求得晶胞的体积,再求得边长,据此答题.
解答 解:(1)同周期从左到右第一电离能增大,第IIA与IIIA反常,因为Mg的价电子排布式是3s2,处于全满状态,较稳定,而Al是3s23p1,所以第一电离能:Mg>Al,
Ti的原子序数为22,位于周期表中的第四周期第ⅣB族,其电子排布为[Ar]3d24s2,
故答案为:>;[Ar]3d24s2;
(2)Al2Cl6的结构为 ,每个Al原子含有4个价层电子对,则Al原子的杂化方式为sp3杂化;每个Al原子形成3个共价键和一个配位键,则Al2Cl6中含有共价键、配位键,共价单键中含有σ键,双键中含有π键,分子中没有双键,所以没有π键;
,每个Al原子含有4个价层电子对,则Al原子的杂化方式为sp3杂化;每个Al原子形成3个共价键和一个配位键,则Al2Cl6中含有共价键、配位键,共价单键中含有σ键,双键中含有π键,分子中没有双键,所以没有π键;
故答案为:sp3;d;
(3)根据晶胞的结构图可知,铁原子分布在立方体的体心、顶点、棱边的中点、面心,利用均摊法可知晶胞中含有铁原子数为1+6×$\frac{1}{2}$+12×$\frac{1}{4}$=8,铝原子分布在立方体的体内,数目为4,所以铝原子与铁原子的个数之比为4:8=1:2;
根据晶胞的结构图可知,铁原子数为8,铝原子分布在立方体的体内,数目为4,
设晶胞的边长为a,则晶胞的密度ρ=$\frac{\frac{8×56+4×27}{{N}_{A}}}{{a}^{3}}$,
所以a=$\root{3}{\frac{556}{ρ{N}_{A}}}$,
故答案为:1:2;$\root{3}{\frac{556}{ρ{N}_{A}}}$.
点评 本题主要考查了物质结构与性质,题目涉及第一电离能、电子排布式、杂化类型的判断、配位键、晶胞的计算,难度中等,解题时要注意对均摊法和晶胞密度公式的正确运用.

 阅读快车系列答案
阅读快车系列答案| A. | 原子序数:W>X>Y>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 离子半径:W3+>Y2->Z+ | D. | 单质沸点:W>X>Y>Z |
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
| A. | 氨常用作制冷剂,是因为其沸点较高,很容易液化 | |
| B. | 常温下氨水与铁不反应,因此氨水可盛放在铁桶里 | |
| C. | 用热的纯碱溶液洗去油污,是因为纯碱可以增强油污的挥发性 | |
| D. | 氯气具有强氧化性,因此可漂白有色布料 |
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
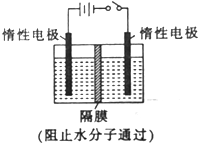 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.