题目内容
15.为除去粗盐中的少量泥沙和钙离子,镁离子,硫酸根等杂质离子,先将粗盐溶于水,过滤,然后对铝业进行四项操作 ①过滤 ②加适量盐酸 ③加过量氢氧化钠和碳酸钠混合溶液 ④加入过量氯化钡溶液.上述操作正确顺序为( )| A. | ②①③④ | B. | ②③④① | C. | ④②③① | D. | ④③①② |
分析 除去粗盐中的Ca2+、Mg2+、SO42-,盐酸要放在过滤之后,用于除去过量的氢氧化钠和碳酸钠;要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,即碳酸钠溶液要放在氯化钡溶液之后,以此解答该题.
解答 解:要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果先加入碳酸钠溶液,过量的钡离子就无法除去;至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子沉淀完全,然后进行过滤,最后加盐酸除去过量的氢氧根离子碳酸根离子,所以正确的顺序为:④③①②.
故选D.
点评 本题考查物质分离提纯的方法和选择,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.现有三组混合物:①水和苯 ②汽油和柴油 ③碘和氯化钠单质溶液,正确的分离方法依次是( )
| A. | 萃取,蒸馏,分液 | B. | 分液,萃取,蒸馏 | C. | 蒸馏,萃取,分液 | D. | 分液,蒸馏,萃取 |
10.下列措施能减慢化学反应速率的是( )
| A. | 双氧水分解时加入二氧化锰 | B. | 将块状药品研细后在进行反应 | ||
| C. | 用较浓的盐酸代替稀盐酸与锌反应 | D. | 将易腐败的食物储存在冰箱里 |
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |
4.W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中 的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体.已知反应:甲+乙→丁+己,甲+丙→戊+己.又知常温下0.01mol•L-1丁溶液的pH为12.下列说法正确的是( )
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
5.下列有关叙述中不正确的是( )
| A. | 酯存在于许多水果鲜花中具有特殊的香味 | |
| B. | 乙酸和甲醇在一定条件下也能发生酯化反应 | |
| C. | 酯化反应也属于取代反应 | |
| D. | 酯化反应中需要稀硫酸做催化剂 |
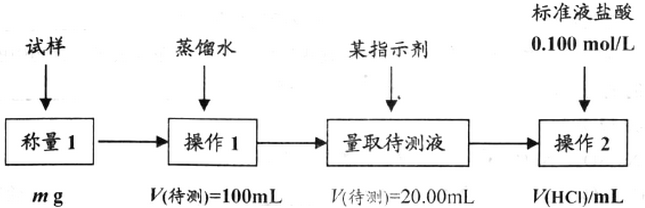
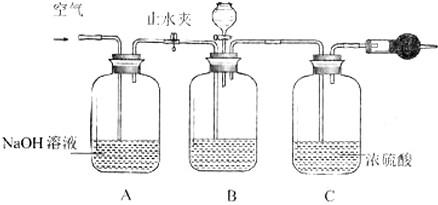
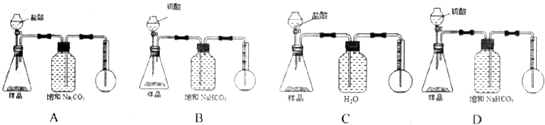

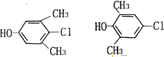 (写两种)
(写两种) 的化学方程式
的化学方程式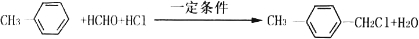 ,
,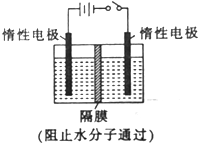 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.