题目内容
10.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
分析 X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素,据此解答.
解答 解:X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素.
A.Na2O、Na2O2中阴、阳离子的个数比都是1:2,但前者含有离子键,后者含有离子键、共价键,故A错误;
B.元素非金属性越强,其气态氢化物的稳定性越强,非金属性N(Cl)>M(S),所以气态氢化物的热稳定性:M<N,故B错误;
C.M是S元素、X是O元素,二者形成的化合物对应的水化物中H2SO4是强酸,但H2SO3是弱酸,故C错误;
D.电子层结构相同的离子,离子半径随着核电荷数增大而减小,所以离子半径:r(O2-)>r(Na+),故D正确;
故选D.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,注意对元素化合物知识的理解掌握,注意掌握微粒半径比较规律,难度不大.

练习册系列答案
相关题目
13.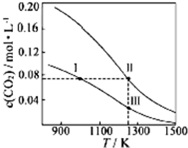 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
15.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
| A. | Cl2、Al、H2 | B. | F2、K、HCl | C. | NO2、Na、Br2 | D. | HNO3、SO2、H2O |
2.20世纪80年代人们发现了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子中C60(足球烯,分了中含有30个双键)是具代表性.X为n个C60连接而成的物质,结构如图( )
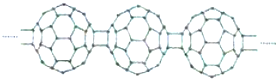

| A. | C60转变为X是物理变化 | B. | X中含积极性共价键 | ||
| C. | X与金刚石互为同位素 | D. | X能够发生加成反应 |
19.W、X、Y、Z是四种短周期元素,X、Y处于同一周期,X的主族序数是周期序数的2倍,Y2-、Z+、W3+的电子层结构相同,下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 离子半径:W3+>Y2->Z+ | D. | 单质沸点:W>X>Y>Z |
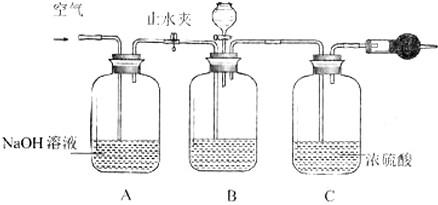
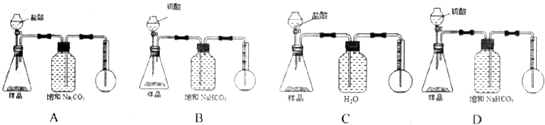
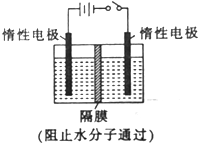 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.