题目内容
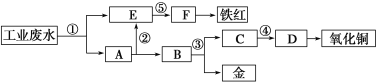
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)A的电子式为___。
(2)在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为___。
(3)工业上常用过量的Na2CO3溶液吸收C,生成等物质的量的两种硝酸盐,该反应的离子方程式为___。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,则该反应的化学方程式为___。某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:____。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)若将标准状况下2.24L的W通入150mL1mol·L-1的A溶液中,充分反应。总反应的离子方程式为____。
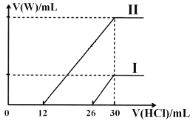
(2)向两份30mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为___。
【答案】![]() 8NH3+6NO2
8NH3+6NO2![]() 7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
7N2+12H2O 2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3- 2H2S+SO2=3S↓+2H2O 2H2SO3+O2=4H++2SO42- 2CO2+3OH-=CO32-+HCO3-+H2O 1∶3
【解析】
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。则A是氨气、B是一氧化氮、C是二氧化氮、W是氧气、D是硝酸。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,C是二氧化硫,则A是硫化氢、B是S、W是氧气;
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色,说明都含钠元素;C常作面包和糕点的发泡剂,受热分解可生成B,则C是碳酸氢钠,B是碳酸钠,W是二氧化碳,A是氢氧化钠。
Ⅰ.(1)A是氨气,电子式为![]() 。
。
(2)在催化剂作用下,氨气与二氧化氮反应生成的两种无污染物质是氮气和水,该反应化学方程式为8NH3+6NO2![]() 7N2+12H2O。
7N2+12H2O。
(3)Na2CO3溶液吸收二氧化氮,生成等物质的量的两种硝酸盐,根据得失电子守恒,生成的两种硝酸盐是硝酸钠和亚硝酸钠,该反应的离子方程式为2NO2+2CO32-+H2O ===NO3-+NO2-+2HCO3-。
Ⅱ.常温下H2S与SO2发生氧化还原反应生成单质硫,该反应的化学方程式为2H2S+SO2=3S↓+2H2O。亚硫酸被氧化为硫酸,所以酸雨的pH呈减小趋势,反应的离子方程式是2H2SO3+O2=4H++2SO42-。
Ⅲ.(1)标准状况下,2.24L二氧化碳的物质的量是0.1mol, 150mL1mol·L-1的氢氧化钠溶液中氢氧化钠的物质的量是0.15mol,氢氧化钠和二氧化碳的比是3:2,根据元素守恒,反应生成0.5mol碳酸钠和0.5mol碳酸氢钠。反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O。
(2)碳酸钠溶液中逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;
依据情况Ⅰ可知,26-30段为碳酸氢钠与盐酸反应,则溶液中碳酸钠消耗的盐酸体积为30-26=4ml,说明溶质为碳酸钠与氢氧化钠混合物,依据方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.004L×0.2molL-1=0.0008mol;
依据情况Ⅱ知,12-30段为碳酸氢钠与盐酸反应,若溶质为碳酸钠则溶液中碳酸钠消耗的盐酸体积为30-12=18mL,而Ⅱ中0-12mL<18mL,说明Ⅱ中溶质为碳酸钠和碳酸氢钠,前12mL盐酸为碳酸钠与盐酸反应生成碳酸氢钠,依据Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.012L×0.2molL-1=0.0024mol;所以M、N两溶液中相同组分溶质碳酸钠的物质的量之比为:0.0008mol;0.0024mol=1:3。

 名校课堂系列答案
名校课堂系列答案