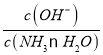题目内容
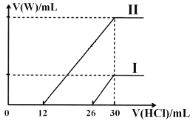
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )

A.实验I中溶液红色褪去,说明发生了反应H++OH-![]() H2O
H2O
B.实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中仍然存在大量的Na+与OH
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
【答案】D
【解析】
A. Ba(OH)2与盐酸发生中和反应:H++OH-![]() H2O,溶液红色褪去,故A正确;
H2O,溶液红色褪去,故A正确;
B. Na2SO4与Ba(OH)2溶液发生反应生成硫酸钡沉淀和氢氧化钠,实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH,故B正确;
C. H2SO4与Ba(OH)2溶液发生反应2H++SO42-+Ba2++2OH—= 2H2O+BaSO4↓,溶液碱性减弱,导电离子浓度减小,则实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,故C正确;
D. 将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,发生反应![]() ,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误;
,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误;
故选D。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
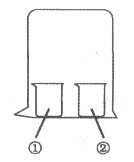
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D