题目内容
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(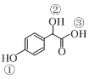 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
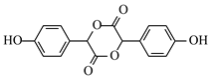
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
【答案】苯酚 OHC—COOH ③>①>② 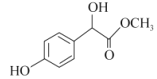
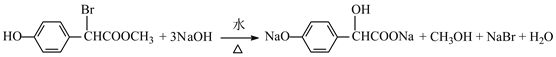
 还原反应 3
还原反应 3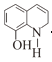 +
+![]()
![]() 3
3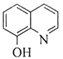 +
+![]() +H2O
+H2O
【解析】
I.A与B发生加成反应产生C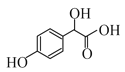 ,根据A的分子式(C6H6O)及C的结构可知A是苯酚,结构简式是
,根据A的分子式(C6H6O)及C的结构可知A是苯酚,结构简式是![]() ,B是OHC-COOH,C与CH3OH在浓硫酸催化下,发生酯化反应产生D为
,B是OHC-COOH,C与CH3OH在浓硫酸催化下,发生酯化反应产生D为 ,D与浓氢溴酸再发生取代反应产生F为
,D与浓氢溴酸再发生取代反应产生F为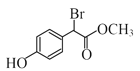 ;若E分子中含有3个六元环,说明2个分子的C也可以发生酯化反应产生1个酯环,得到化合物E,结构简式为
;若E分子中含有3个六元环,说明2个分子的C也可以发生酯化反应产生1个酯环,得到化合物E,结构简式为 。
。
II.A是苯酚![]() ,A与浓硝酸发生苯环上邻位取代反应产生G是
,A与浓硝酸发生苯环上邻位取代反应产生G是![]() ,G发生还原反应产生H为
,G发生还原反应产生H为![]() ,H与丙烯醛CH2=CH-CHO发生加成反应产生
,H与丙烯醛CH2=CH-CHO发生加成反应产生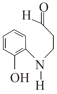 ,
, 与浓硫酸在加热时反应形成K:
与浓硫酸在加热时反应形成K: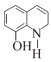 。
。
I.根据上述推断可知:A是![]() ,B是OHC-COOH,D是
,B是OHC-COOH,D是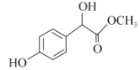 ,E是
,E是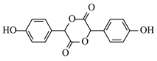 F是
F是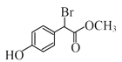 。
。
II.根据上述推断可知G为![]() ,H为
,H为![]() 。
。
(1)A是![]() ,名称为苯酚;B是乙醛酸,B的结构简式是OHC-COOH;
,名称为苯酚;B是乙醛酸,B的结构简式是OHC-COOH;
(2)羧酸的酸性大于苯酚,苯酚的酸性大于醇羟基,因此在物质C(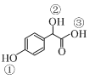 )中①~③羟基氢原子的活性由强到弱的顺序是③>①>②;
)中①~③羟基氢原子的活性由强到弱的顺序是③>①>②;
(3)D的结构简式是 ;
;
(4)F结构简式为 ,含有的酯基与NaOH发生酯的水解反应产生羧酸钠和CH3OH、酚羟基可以与NaOH发生反应产生酚钠、H2O,含有的Br原子可以与NaOH水溶液发生取代反应,Br原子被羟基取代,产生的HBr与NaOH也能发生中和反应,因此F与过量NaOH溶液反应的化学方程式:
,含有的酯基与NaOH发生酯的水解反应产生羧酸钠和CH3OH、酚羟基可以与NaOH发生反应产生酚钠、H2O,含有的Br原子可以与NaOH水溶液发生取代反应,Br原子被羟基取代,产生的HBr与NaOH也能发生中和反应,因此F与过量NaOH溶液反应的化学方程式: +3NaOH
+3NaOH![]()
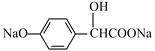 +CH3OH+NaBr+H2O;
+CH3OH+NaBr+H2O;
(5)若E分子中含有3个六元环,则E的结构简式是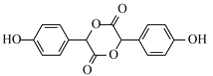 ;
;
(6) G为![]() ,H为
,H为![]() 。G→H的反应类型是硝基被还原为氨基的反应,所以反应类型是还原反应;
。G→H的反应类型是硝基被还原为氨基的反应,所以反应类型是还原反应;
(7)在一定条件下 与
与![]() 发生反应产生
发生反应产生 、
、![]() 、H2O,根据质量守恒定律,可得3
、H2O,根据质量守恒定律,可得3 +
+![]()
![]() 3
3 +
+![]() +H2O。
+H2O。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是946kJ·mol-1,则上述反应的ΔH=_________________。
(2)上述反应的平衡常数K的表达式为____________,若反应方程式改写为NH3(g)![]() N2(g)+
N2(g)+![]() H2(g),则平衡常数K1=____________________(用K表示)。
H2(g),则平衡常数K1=____________________(用K表示)。
(3)在773K时,分别将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | m | 1.80 | 1.98 | 2.00 | 2.00 |
①表格中m=_______________/span>,15~25min内,v(N2)=_______________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol·L-1,此时v正_______v逆(填“>”、“<”或“=”)。
③由表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是______________(填“甲”、“乙”或“丙”)。在此温度下,若起始充入4mol N2和12mol H2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为_________________。

(4)Marnellos和Stoukides采用电解法合成氨,实现了常压合成和氮气的高转化率。该方法用SCY陶瓷将两极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,则阴极的电极反应为____________________。
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
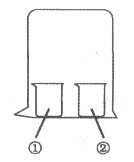
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D