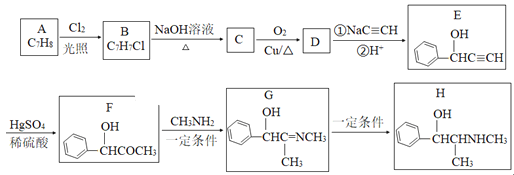
题目内容
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L三氧化硫中所含分子数约为0.1NA
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8%
C.一定温度下,1moLFeCl3可生成NA个Fe(OH)3胶体颗粒
D.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移NA个电子
【答案】B
【解析】
A. 标况下,三氧化硫是固体,不能用22.4L/mol计算SO3物质的量,2.24LSO3物质的量不是1mol,含有SO3分子数不是0.1NA,故A错误;
B. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为![]() ×100%(ρ浓、ρ稀分别为浓硫酸、稀硫酸的密度),硫酸密度大于水,加水稀释时密度改变,硫酸浓度越小密度越小,ρ浓>ρ稀,则稀释后硫酸的质量分数大于9.8%,故B正确;
×100%(ρ浓、ρ稀分别为浓硫酸、稀硫酸的密度),硫酸密度大于水,加水稀释时密度改变,硫酸浓度越小密度越小,ρ浓>ρ稀,则稀释后硫酸的质量分数大于9.8%,故B正确;
C. Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,1molFeCl3完全水解,产生Fe(OH)3胶体粒子小于NA,故C错误;
D. H2O2中O为-1价,每个O得到一个电子变成-2价,即反应每生成1molO2转移2mol电子,32gO2就是1molO2,反应中转移2NA个电子,故D错误;
答案是B。

【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
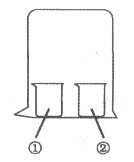
①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | MgCl2溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. AB. BC. CD. D
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
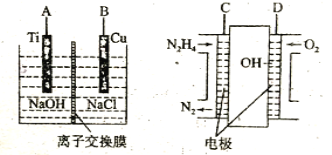
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。