题目内容
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
【答案】A
【解析】
A、Cu(NO3)2的物质的量是1mol,根据N守恒可得n(KNO3)= 6.0 mol/L×0.5L-2mol=1mol,所以c(K+)= c(KNO3)=![]() =2mol/L,选项A正确;
=2mol/L,选项A正确;
B、电解KNO3和Cu(NO3)2的混合溶液,在阳极发生反应:4OH--4e-=2H2O+O2↑。n(O2)= ![]() =1mol。则转移电子4mol,因此选项B错误;
=1mol。则转移电子4mol,因此选项B错误;
C、在阴极首先发生反应:Cu2++2e-=Cu,然后发生:2H++2e-=H2↑。由于产生氢气的物质的量是1mol,得到电子2mol,则产生Cu转移的电子也是2mol,产生Cu 1mol。所以选项C错误;
D、因为在反应过程中放电的OH-的物质的量与H+及电子的物质的量相等,因为电子转移4mol,所以电解后溶液中H+的物质的量也是4mol,所以c(H+)=![]() =8mol/L ,所以选项D错误;
=8mol/L ,所以选项D错误;
答案选A。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】X、Y、Z、W四种短周期元素,有关数据如下表,下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 66 | 70 | 143 | 160 |
主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
A. W和Y形成的化合物为共价化合物
B. Y的最高价氧化物对应的水化物为强酸
C. Y的简单气态氢化物的沸点高于X的简单气态氢化物
D. 工业上经常采用电解Z的氯化物溶液制备Z单质
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
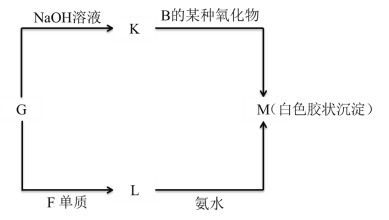
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。
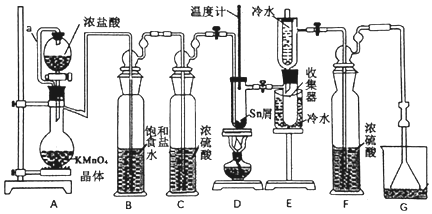
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。
已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。