题目内容
3.下列说法不正确的是( )| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
分析 A.金属晶体中金属阳离子半径越小,电荷越多,金属键越强;
B.离子晶体的晶格能大小决定了晶体熔点高低;
C.离子键是带相反电荷的离子之间的相互作用;
D.在晶胞中处于立方体顶点的微粒在三维坐标中被8个晶胞共用.
解答 解:A.金属晶体中金属阳离子半径越小,电荷越多,金属键越强,钠离子的半径比钾离子小,所以金属钠中的金属键比金属钾中的金属键强,故A正确;
B.离子晶体的晶格能大小决定了晶体熔点高低,晶格能越大,熔点越高,离子晶体分解破坏离子键,故B错误;
C.离子键是带相反电荷的离子之间的相互作用,它是一种静电作用力,没有方向性和饱和性,故C正确;
D.在晶胞中处于立方体顶点的微粒在三维坐标中被8个晶胞共用,故D正确.
故选B.
点评 本题考查了金属键、晶格能、离子键、晶胞等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
12.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | $\frac{1}{2}$C(s)+O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | HCl(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H1; H2(g)+Cl2(g)=2HCl(g)△H2 |
15.对下列各图曲线表征的信息解毒错误的是( )
| A. | 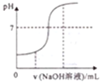 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 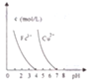 pH=7时,Cu2+、Fe3+都能沉淀完全 |
13.根据图示装置,下列说法不正确的是( )
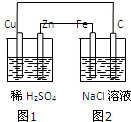

| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
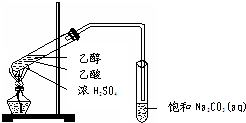 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.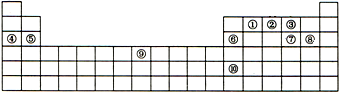 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素. 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示: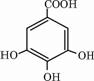 .
.