题目内容
8.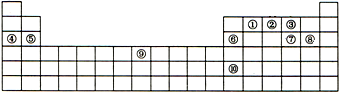 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素.(1)元素⑥的元素名称是铝,元素⑤位于元素周期表的s区;
(2)元素①原子的价电子数是4,元素⑨在元素周期表的第4周期第ⅤⅢ族;
(3)在元素①、②、③中,非金属元素最强的是O(用所对应的元素符号表示.下同).元素③、⑦、⑧的简单离子的半径由大到小的顺序为S2->Cl->O2-;
(4)元素性质周期表变化的实质是元素原子核外电子排布的周期性变化.元素⑩的单质可能具有的性质是ab(填字母);
a、能导电导热b、能与稀盐酸反应生成氢气c、其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是Al2O3(填化学式).在元素①-⑩的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式);
(6)元素⑨原子的外围电子排布为3d64s2.
分析 据元素在周期表中的位置,可以确定各序号对应的元素,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为In,结合元素周期律和元素周期表的结构及部分元素的性质答题;
解答 解:据元素在周期表中的位置,可以确定各序号对应的元素,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为In,
(1)元素⑥的元素名称是铝,⑤为Mg,位于元素周期表的s区,
故答案为:铝;s;
(2)①为C,其价电子数是4,元素⑨为Fe,在元素周期表的第4周期第ⅤⅢ族,
故答案为:4;ⅤⅢ;
(3)根据元素周期律,同周期元素从左向右,元素非金属性逐渐增强,①为C,②为N,③为O,所以在元素①、②、③中,非金属元素最强的是O,离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以元素③、⑦、⑧的简单离子的半径由大到小的顺序为S2->Cl->O2-,
故答案为:O;S2->Cl->O2-;
(4)元素性质周期表变化的实质是元素原子核外电子排布的周期性变化,⑩为In元素,它与铝同主族,金属性强于铝,所以铟的单质可能具有的性质是能导电导热、能与稀盐酸反应生成氢气、其晶体属金属晶体,故选ab,
故答案为:核外电子排布;ab;
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是Al2O3,在元素①-⑩中,由于氧元素没有氧化物质的水化物,所以除了氧外,非金属性最强的是氯元素,所以①-⑩中最高价氧化物的水化物中,酸性最强的是HClO4,
故答案为:Al2O3;HClO4;
(6)⑨为Fe,铁原子的外围电子排布为3d64s2,
故答案为:3d64s2;
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案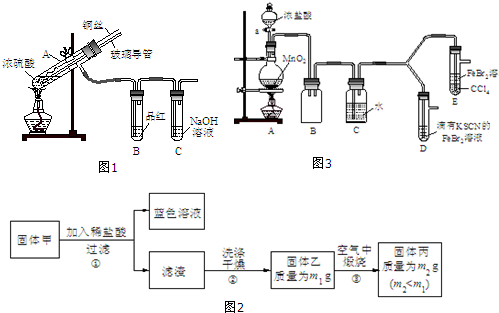
【实验1】用图1实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在
铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S.查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2.为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2实验:
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是在熄灭酒精灯后,B中的液体不会倒吸.
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(3)确定乙是否煅烧完全的操作是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g).
(4)煅烧过程中一定发生的化学反应方程式为2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+2SO2.
【实验2】某化学兴趣小组设计了如图3实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱.
(5)根据下列实验操作和现象,填写实验结论.
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
请设计简单实验证明上述解释取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理,或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-.
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
| A. | 10 | B. | 11 | C. | 13 | D. | 15 |
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO2和O3 | B. | CH4和NH4+ | C. | NH2-和H2O2 | D. | HCl和H2O |
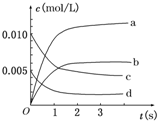 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.