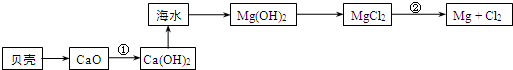
题目内容
13.根据图示装置,下列说法不正确的是( )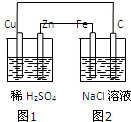
| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
分析 图1为铜锌原电池,锌比铜活泼是负极,负极上失电子发生氧化反应,铜为正极得电子发生还原反应;图2为电解池,与铜相连的C为阳极失电子发生氧化反应,与锌相连的铁为阴极得电子发生还原反应,据此分析.
解答 解:A、图1为铜锌原电池,图2为电解池,故A正确;
B、图2中,与锌相连的铁为阴极得电子发生还原反应,反应式为:2H++2e-═H2↑,故B错误;
C、图1为铜锌原电池,H+向正极Cu电极移动,图2为电解池,H+向阴极Fe电极移动,故C正确;
D、图1为铜锌原电池,总反应为Zn+2H+=Zn2++H2↑,消耗氢离子,则溶液的pH增大,图2为电解池,电解氯化钠溶液生成氢氧化氢气和氯气,所以溶液的pH增大,故D正确;
故选B.
点评 本题考查了原电池、电解池原理,明确原电池正负极的判断方法、电解池离子放电顺序即可解答,难点是电极反应式的书写,难度中等.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
3.下列说法不正确的是( )
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
4.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
8.常温下,下列物质存放方法正确的是( )
| A. | 氢氧化钠溶液用带玻璃塞的玻璃瓶存放 | |
| B. | 金属钠保存在水中 | |
| C. | 浓硝酸存放于无色细口瓶中 | |
| D. | 浓硫酸贮存在铝制容器中 |
18.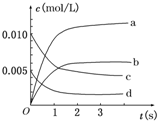 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)用O2表示0~2s内该反应的平均速率v=0.0015mol/(L•s);
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
5.下列说法正确的是( )
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
2.如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )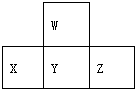

| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有2种氧化物且都能与元素W的氢化物反应生成对应价态的酸 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | 原子半径的大小顺序是Z>Y>X>W |
3.下列不能由两种单质直接化合得到的物质是( )
| A. | FeCl3 | B. | CuCl2 | C. | FeS | D. | CuS |