题目内容
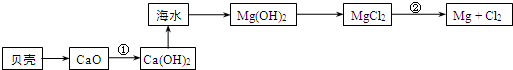
12. 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:(1)1molA最多可与8mol NaOH反应.
(2)A不具有的性质是②⑤(填写序号).
①与FeCl3溶液发生显色反应
②加聚反应
③与溴水发生取代反应
④与碳酸氢钠溶液反应生成二氧化碳
⑤与溴水发生加成反应
(3)有机化合物B在浓硫酸催化条件下加热发生酯化反应可得到A.请写出B的结构简式
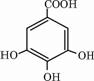 .
.
分析 (1)根据有机物的官能团判断水解后呈酸性的官能团,可确定消耗NaOH的量;
(2)有机物含有酚羟基、酯基和羧基,根据有机物的官能团判断有机物具有的性质;
(3)A中含有-COO-,根据水解产物可判断B的结构简式.
解答 解:(1)A与过量NaOH发生反应,酚羟基、酯基、羧基均可与NaOH反应,反应的方程式为 ,故1molA消耗8molNaOH,
,故1molA消耗8molNaOH,
故答案为:8;
(2)A中含有酚羟基,可与溴水发生取代反应,可与FeCl3溶液发生显色反应,含有羧基,可与与碳酸氢钠溶液反应生成二氧化碳,但因无C=C,不能发生加聚反应,不能与溴水发生加成反应,故答案为:②⑤;
(3)据题意:2分子B发生酯化反应得1分子A,故可根据A的结构简式推出B的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构和性质,侧重于有机物知识的综合应用,为高考常见题型,难度不大,注意把握有机物的结构和官能团的性质,为解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列说法不正确的是( )
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
20.下列有关实验的现象与对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
7.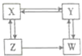 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )| A. | X是羧酸,Y是酯 | B. | Y是醛,W是醇 | C. | Z是醛,W是羧酸 | D. | X是醇,Z是酯 |
17.下列粒子属等电子体的是( )
| A. | SO2和O3 | B. | CH4和NH4+ | C. | NH2-和H2O2 | D. | HCl和H2O |
4.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
2.如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )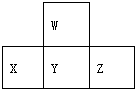

| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有2种氧化物且都能与元素W的氢化物反应生成对应价态的酸 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | 原子半径的大小顺序是Z>Y>X>W |