题目内容
15.对下列各图曲线表征的信息解毒错误的是( )| A. | 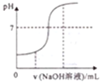 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 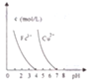 pH=7时,Cu2+、Fe3+都能沉淀完全 |
分析 A.酸性溶液的pH小于7,滴加氢氧化钠,pH增大;
B.反应物总能量大于生成物总能量,则该反应的正反应是放热反应,催化剂能改变活化能;
C.水的电离为吸热过程,升高温度电离程度增大;
D.由图可知,pH=7时,Cu2+、Fe3+的浓度几乎为零.
解答 解:A.酸性溶液的pH小于7,滴加氢氧化钠,pH增大,图象符合,故A正确;
B.反应物总能量大于生成物总能量,则该反应的正反应是放热反应,催化剂能改变活化能,但不改变焓变,故B错误;
C.水的电离为吸热过程,升高温度电离程度增大,c(H+)与c(OH-)均增大,图象符合,故C正确;
D.由图可知,pH=7时,Cu2+、Fe3+的浓度几乎为零,所以pH=7时,Cu2+、Fe3+都能沉淀完全,故D正确.
故选B.
点评 本题考查了酸碱中和、化学反应能量与图象、水的电离的影响因素、沉淀的生成等,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
相关题目
4.下列Ⅰ、Ⅱ叙述正确并且有因果关系的是( )
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
6.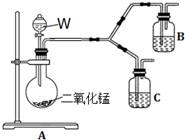 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
(1)为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为≥5mL.
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
3.下列说法不正确的是( )
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
10.将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
20.下列有关实验的现象与对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
7.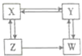 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )| A. | X是羧酸,Y是酯 | B. | Y是醛,W是醇 | C. | Z是醛,W是羧酸 | D. | X是醇,Z是酯 |
4.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
5.下列说法正确的是( )
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |