题目内容
18.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:(1)天然水中溶解的气体主要有O2、CO2(或N2).
(2)水的净化与软化的区别是水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小.
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=6×10-4mol•L-1,c(Mg2+)=3×10-4mol•L-1,则此水的硬度为5°.
分析 (1)空气中的氧气不易溶于水,二氧化碳能溶于水,其它气体一般是难溶于水;
(2)净化水是除去悬浮杂质,软化水是除去钙镁离子;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到.
解答 解:(1)氧气能够较少量地溶解在水中,二氧化碳能够较多量地溶解在水中,所以天然水中溶解的气体主要有氧气和二氧化碳,
故答案为:O2、CO2(或N2);
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小;
(3)某天然水中c(Ca2+)=6×10-4mol•L-1,c(Mg2+)=3×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=6×10-4mol,相当于CaO质量=6×10-4mol×56g/mol=33.6mg,1L水中镁离子物质的量=3×10-4mol,相当于氧化镁质量3×10-4mol×40g/mol=12mg,所以水的硬度=$\frac{33.6mg}{10mg}$+$\frac{12mg}{7.1mg}$=5°
故答案为:5°.
点评 本题考查了水的净化及计算,题目难度中等,注意掌握水的净化方法,明确水的硬度的计算方法,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
6. 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
(1)为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为≥5mL.
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
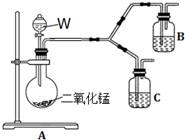
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
13.月季花适宜在酸性土壤中生长.某同学给月季花施肥前,对下列氮肥溶液的pH进行了测定,结果如下:
该同学最好选用( )
| 化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氢铵 | B. | 尿素 | C. | 氨水 | D. | 硫酸铵 |
3.下列说法不正确的是( )
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
10.将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
7.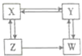 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )| A. | X是羧酸,Y是酯 | B. | Y是醛,W是醇 | C. | Z是醛,W是羧酸 | D. | X是醇,Z是酯 |
8.常温下,下列物质存放方法正确的是( )
| A. | 氢氧化钠溶液用带玻璃塞的玻璃瓶存放 | |
| B. | 金属钠保存在水中 | |
| C. | 浓硝酸存放于无色细口瓶中 | |
| D. | 浓硫酸贮存在铝制容器中 |
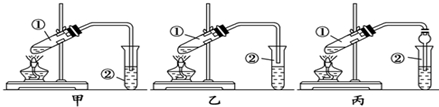
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;