题目内容
13.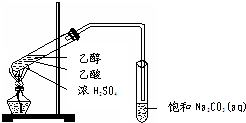 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:在一个30mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),然后轻轻振荡试管,使之混合均匀.
(2)浓硫酸的作用是①催化作用,②吸水作用.
(3)饱和Na2CO3溶液的作用是吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度.
(4)生成乙酸乙酯的化学方程式CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
分析 (1)从浓硫酸溶于水放热和加热时试管内液体的体积不超过试管容积的“$\frac{1}{3}$”分析,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
(2)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(3)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
(4)酯化反应的本质为酸脱羟基,醇脱氢,在A中反应生成乙酸乙酯和水,且为可逆反应;产物乙酸乙酯在上层,所以密度比水小;根据乙酸乙酯的物理性质分析
其气味.
解答 解:(1)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的“$\frac{1}{3}$”,加入药品的顺序为在一个30mL大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸和3mL乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL),
故答案为:在一个30mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换);
(2)乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
故答案为:催化作用、吸水作用;
(3)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度;
(4)酯化反应的本质为酸脱羟基,醇脱氢,在A中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,产物乙酸乙酯在上层,所以密度比水小;乙酸乙酯具有芳香气味,
CH3COOC2H5+H2O,产物乙酸乙酯在上层,所以密度比水小;乙酸乙酯具有芳香气味,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;小;芳香.
CH3COOC2H5+H2O;小;芳香.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意理解饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
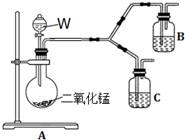
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
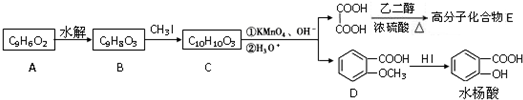
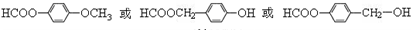 .
.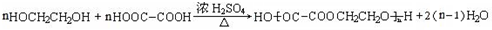 .
.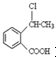 为原料制备
为原料制备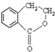 的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$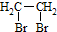 .
.