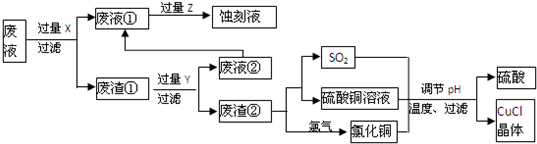
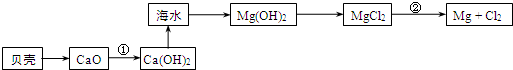
题目内容
11.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4.1mol A的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,此时A转变成与氖原子具有相同电子层结构的离子.试回答:(1)A是Na元素,B是Al元素,C是Cl元素.(填元素名称)
(2)分别写出A、B的最高正价氧化物对应的水化物与C的气态氢化物水溶液反应的离子方程式:H++OH-=H2O;Al(OH)3+3H+=Al3++3H2O.
(3)A原子的还原性比B原子的还原性强,这是由于Na的原子半径大于Al,钠比Al更易失去电子.
分析 A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出11.2L的H2,即0.5mol,A为金属,设A反应后化合价为x,则根据电子转移守恒,1x=0.5×2,所以x=1,即A反应后为+1价,这时A转变为与氖原子具有相同电子层结构的离子,则A为Na元素;而B的核电荷数比A大2,则B为Al元素;C原子的电子总数比B原子的电子总数多4,则C为Cl元素,结合元素单质、化合物的性质解答该题.
解答 解:A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出11.2L的H2,即0.5mol,A为金属,令A反应后化合价为x,则根据电子转移守恒,1x=0.5×2,所以x=1,即A反应后为+1价,这时A转变为与氖原子具有相同电子层结构的离子,则A为Na元素;而B的核电荷数比A大2,则B为Al元素;C原子的电子总数比B原子的电子总数多4,则C为Cl元素,
(1)由以上分析可知A为Na,B为Al,C为Cl,
故答案为:Na;Al;Cl;
(2)A、B的最高价氧化物对应的水化物分别NaOH和Al(OH)3,C的气态氢化物为HCl,
分别发生中和反应,反应的离子方程式分别为:H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O,
故答案为:H++OH-=H2O;Al(OH)3+3H+=Al3++3H2O;
(3)Na的原子半径大于Al,则钠比Al更容易失去电子,所以Na的还原性比Al强,
故答案为:强;Na的原子半径大于Al,钠比Al更易失去电子.
点评 本题考查结构性质与位置关系、离子方程式等化学用语、化学计算等,题目难度中等,根据计算推断A元素是解题关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

| A. | 环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 | |
| B. | 食盐中加入少量碘化钾,食用后可补充人体内碘元素的不足 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 晶体硅是通信工程中制作光导纤维的主要原料 |
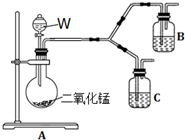 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(2)已知:25℃时Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K=5.4×109.
(3)步骤V中产生的白色沉淀的化学式为BaSO4,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有S.
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置.
①装置A中玻璃仪器有圆底烧瓶、导管和分液漏斗,试剂W为过氧化氢溶液.
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为Ag2S悬浊液.
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
□Ag2S+□NaCl+□O2+□H2O?□AgCl+□S+□NaOH
C中NaCl的作用是:氧气将Ag2S氧化成S时有Ag+产生,NaCl电离的氯离子与银离子结合生成AgCl沉淀,使c(Ag+)减小,有利于氧化还原反应的平衡右移.
| A. | 通常状况下,金属钠中的金属键比金属钾中的金属键强 | |
| B. | 晶格能的大小反映了离子晶体开始分解温度的高低 | |
| C. | 离子键没有方向性和饱和性 | |
| D. | 在晶胞中处于立方体顶点的一种或离子为8个晶胞共享 |
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |