题目内容
16.某温度下,将2mol A和1mol B放入一密闭容器中,发生反应:A(g)+B(g)?2C(s)+2D(g),5min后反应达到平衡,测得生成C为0.8mol,下列相关表述正确的是( )| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
分析 A.化学平衡常数指,一定温度下可逆达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意纯液态、固体不需要写出;
B.C为固体,加入少量生成物C,不影响反应速率;
C.该反应前后气体体积不变,增大该体系的压强,平衡不移动;
D.5min后反应达到平衡,测得生成C为0.8mol,结合方程式计算参加反应B的物质的量,进而计算B的转化率.
解答 解:A.可逆反应A(g)+B(g)?2C(s)+2D(g),由于C为固体,故该反应平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$,故A错误;
B.C为固体,加入少量生成物C,不影响反应速率,正、逆反应速率不变,故B错误;
C.该反应前后气体体积不变,增大该体系的压强,平衡不移动,A的转化率不变,故C错误;
D.5min后反应达到平衡,测得生成C为0.8mol,由A(g)+B(g)?2C(s)+2D(g),可知参加反应B的物质的量为0.8mol×$\frac{1}{2}$=0.4mol,故B的转化率为$\frac{0.4mol}{1mol}$×100%=40%,故D正确,
故选D.
点评 本题考查化学平衡计算、化学平衡常数、化学平衡影响因素、化学反应速率影响因素,难度不大,注意理解压强对反应速率与化学平衡的影响.

练习册系列答案
相关题目
10.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
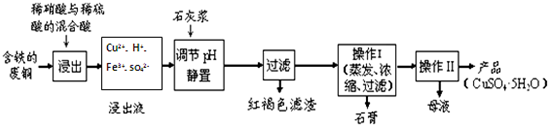
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.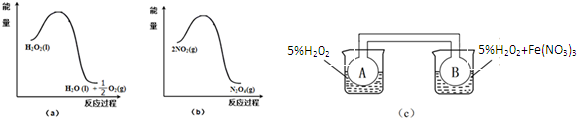
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.

4.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(2)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(4)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(2)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
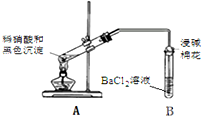 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(4)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
1.反应:xA(气)+yB(气)?zC(气),达到平衡时测得A气体的浓度为0.5mol•L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol•L-1,则下列叙述正确的是( )
| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
8.上世纪50年代日本西部的婴儿大批发生贫血、腹泻、呕吐等症状,经调查都是食用“森永”牌奶粉所致,化验发现奶粉中含As量极高,As的来源是由于加入奶粉中的稳定剂Na2HPO4中含As严重超标.所以,切勿忽视添加剂的规格及级别,决不能随便代用.As在元素周期表中的位置是( )
| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
6.下列分子中所有原子未全部满足最外层为8个电子结构的是( )
| A. | N2 | B. | CO2 | C. | BF3 | D. | PCl3 |
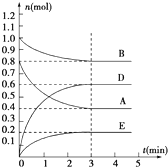 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示: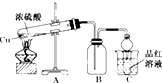 某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.
某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验. 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.