题目内容
5. 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.(1)氰酸(HOCN)的结构式是N≡C-O-H,其中碳原子的杂化方式是sp,根据等电子体原理,可推测氰酸根离子的空间构型是直线型.
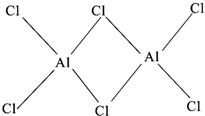
(2)用Cr2O3作原料,铝粉作还原剂的铝热法是生产金属铬的主要方法之一,该反应是一个自发放热反应,由此可判断Cr-O键和Al-O键中Al-O键更强.研究发现气态氯化铝(Al2Cl6)是具有配位键的化合物,可溶于非极性溶剂,分子中原子间成键的关系如图所示.由此可知该分子是非极性 (填“极性”或“非极性”)的.请在图中是配位键的斜线上加上箭头.
(3)铁有α、γ、δ三种晶体构型,其中α-Fe单质为体心立方晶体,δ-Fe单质为简单立方晶体.则这两种晶体结构中铁原子的配位数之比是4:3,设α-Fe晶胞边长为a nm,δ-Fe晶胞边长为bnm,则这两种晶体的密度比为2b3:a3.(用a、b的代数式表示)
(4)氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计). 基态Ni2+有2 个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm,列式表示其比表面积$\frac{6000}{Dρ}$m2/g.
分析 (1)根据碳为四配位,氮为三配位,氧为两配位确定其结构式;根据价层电子对互斥理论确定其杂化类型;先根据CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似;
(2)根据反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,利用反应热△H=反应物的总键能-生成物的总键能来解答;根据相似相溶原理来解答;先分析铝原子和氯原子的最外层电子,再根据每个原子达到8电子稳定结构分析配位键成键情况;
(3)先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;先根据ρ=$\frac{m}{V}$计算两种晶胞的密度,然后求出两者之比;
(4)先根据Ni的原子序数为28,根据能量最低原理先写出基态原子核外电子排布式,再写出基态Ni2+核外电子排布式来判断;先根据球的表面积和体积公式求出纳米粒子的表面积和体积,再结合密度求出质量从而求出比表面积.
解答 解:(1)碳为四配位,氮为三配位,氧为两配位,故氰酸(HOCN)的结构式是N≡C-O-H;氰酸(HOCN)的结构式是N≡C-O-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化;CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似,所以CNO-的空间构型是直线型;
故答案为:N≡C-O-H;sp;直线型;
(2)反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,△H<O,由反应热△H=反应物的总键能-生成物的总键能可知Cr-O键的键能小于Al-O键,Al-O稳定性更强;气态氯化铝(Al2Cl6)是具有配位键的化合物,可溶于非极性溶剂,根据相似相溶原理可知该分子是非极性分子,Cl原子最外层有7个电子,只能与Al原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构.Al原子最外层有3个电子,可分别与3个Cl原子形成共价键,因而Cl原子与2个Al原子形成的化学键中,必有1个是配位键,由于电子对由Cl原子提供,这样Cl原子最外层电子数仍为8,Al原子最外层也成为8电子结构,如图所示: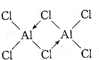 ;
;
故答案为:Al-O;非极性; ;
;
(3)δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3;若α-Fe晶胞边长为acm,γ-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+8×$\frac{1}{8}$):(8×$\frac{1}{8}$)=2:1,密度比=$\frac{\frac{56}{NA}×2}{a3}$:$\frac{\frac{56}{NA}}{b3}$=2b3:a3;
故答案为:4:3;2b3:a3;
(4)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,基态Ni2+核外电子排布式为1s22s22p63s23p63d8,3d有8个电子,其中2个单电子;其纳米粒子的直径为Dnm=D×10-7m,表面积为4π($\frac{D}{2}$×10-7)2cm2=4π($\frac{D}{2}$×10-7)2×10-4 m2=4π($\frac{D}{2}$×10-7)2×10-4 m2=πD2×10-18m2,体积为$\frac{4}{3}$π($\frac{D}{2}$×10-7)3cm3,纳米粒子的质量为$\frac{4}{3}$π($\frac{D}{2}$×10-7)3cm3×ρg/cm3=$\frac{4}{3}$π($\frac{D}{2}$×10-7)3×ρg=$\frac{πD{\;}^{3}ρ}{6}$×10-21g,比表面积为$\frac{π{D}^{2}×1{0}^{-18}{m}^{2}}{\frac{π{D}^{3}ρ}{6}×1{0}^{-21}g}$=$\frac{6000}{Dρ}$;
故答案为:2;$\frac{6000}{Dρ}$;
点评 本题考查了物质的结构中的分子极性、原子的杂化、化学键、配位数的判断、晶胞的计算等知识,难度一般,注意配位键结构式中箭头的方向.

| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中Na+、SiO32-、I-、CO32- | |
| B. | 2%的氨水中Ag+、K+、F-、NO3- | |
| C. | pH=1的溶液中NH4+、Na+、SO42-、C17H35COO- | |
| D. | 0.1mol•L-1的NaHSO4溶液中K+、Fe2+、Cl-、CrO42- |
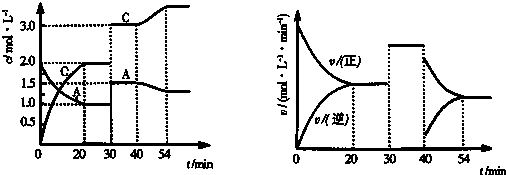
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
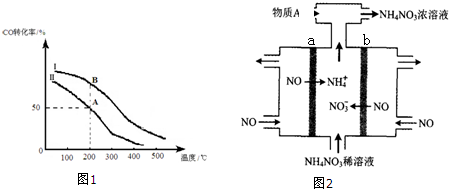
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
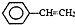 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为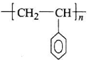
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.