题目内容
9.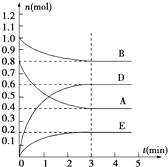 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:(1)反应开始至达到平衡时,用D表示该反应速率为0.1 mol/(L•min).
(2)该反应的化学平衡常数K的数值为1.69(保留至两位小数).
(3)下列措施能增大B的转化率的是ACD.
A.再加入2mol A和1mol B
B.保持体积不变通入1mol B
C.移出部分物质D
D.再加入2mol A、1mol B和0.6mol Dw!
(4)在T℃时,相同容器中,若开始时加入0.2mol A、0.8mol B、0.9mol D、0.5mol E反应,达到平衡后,A的浓度小于0.2mol/L(填“大于”“小于”或“等于”),理由是温度不变,平衡常数不变,若加入0.8 mol A、1.0 mol B,平衡浓度则与图中A浓度相同,题中投入量相当于加入0.8 mol A、1.0 mol B后再加入0.1 mol B,平衡正向移动.
分析 (1)根据图中D的物质的量的变化求出浓度变化,再根据v=$\frac{△c}{△t}$计算v(D);
(2)物质的量的变化量之比等于化学计量数之比,求出方程式的计量数,然后求出平衡时各物质的浓度,再求出平衡常数;
(3)A.增大A的浓度,提高B的转化率;
B.增大B的浓度,A的转化率变大,B的转化率减小;
C.移出部分物质D,减小生成物浓度,平衡正向移动;
D.全部转化为A和B,进行判断;
(4)结合等效平衡思想,把生成物转化为反应物与原来平衡相比较,然后判断平衡时A的浓度.
解答 解:(1)由图1可知,在3min时反应达平衡,D的物质的量的变化为0.6mol,则D的浓度变化量为0.3mol/L,v(D)=$\frac{△c}{△t}$=$\frac{0.3mol/L}{3min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(2)物质的量的变化量之比等于化学计量数之比,所以(0.8-0.4)mol:(1.0-0.8)mol:0.6mol:0.2mol=m:n:p:q,即
m:n:p:q=2:1:3:1,所以方程式为2A(g)+B(g)?3D(g)+E(s),平衡时c(A)=$\frac{0.4mol}{2L}$=0.2mol/L,c(B)=$\frac{0.8mol}{2L}$=0.4mol/L,c(D)=$\frac{0.6mol}{2L}$=0.3mol/L,所以平衡常数k=$\frac{{c}^{3}(D)}{{c}^{2}(A)×c(B)}$=$\frac{0.{3}^{3}}{0.{2}^{2}×0.4}$=1.69,
故答案为:1.69;
(3)A.原投料比为:n(A):n(B)=0.8:1=4:5,先投入比为:n(A):n(B)=2:1,相当于增大了A的浓度,B的转化率增大,故A正确;
B.保持体积不变通入1molB,增大B的浓度,A的转化率变大,B的转化率减小,故B错误;
C.移出部分物质D,减小生成物浓度,平衡正向移动,B的转化率增大,故C正确;
D.再投入2molA、1molB和0.6molD,全部转化为A和B,则n(A)=2+0.6×$\frac{2}{3}$=2.4mol,n(B)=1+0.6×$\frac{1}{3}$=1.2,n(A):n(B)=2.4:1.2=2:1,相当于增大了A的浓度,B的转化率增大,故D正确,
故答案为:ACD;
(4)相同条件下,开始加入0.2molA、0.8molB、0.9molD和0.5molE,按化学计量数转化到左边,可以等效为开始加入0.8molA、1.1molB,A的浓度与原平衡相同,B的浓度比原平衡大,平衡向正反应移动,所以平衡时A的浓度小于原平衡时浓度,即c(A)<0.2mol/L,
故答案为:小于;温度不变,平衡常数不变,若加入0.8 mol A、1.0 mol B,平衡浓度则与图中A浓度相同,题中投入量相当于加入0.8 mol A、1.0 mol B后再加入0.1 mol B,平衡正向移动.
点评 本题以物质的量随时间变化图象为载体,考查学生读图提取信息的能力、分析问题解决问题的能量以及计算能力,侧重于化学平衡有关知识的综合考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ${\;}_{18}^{38}$Ar | 18 | 20 | 19 | 38 |
| ${\;}_{16}^{32}$S2- | 16 | 16 | 18 | 32 |
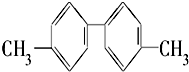
| A. | 分子中至少有4个碳原子处于同一直线上 | |
| B. | 该烃苯环上的一氯代物有4种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中Na+、SiO32-、I-、CO32- | |
| B. | 2%的氨水中Ag+、K+、F-、NO3- | |
| C. | pH=1的溶液中NH4+、Na+、SO42-、C17H35COO- | |
| D. | 0.1mol•L-1的NaHSO4溶液中K+、Fe2+、Cl-、CrO42- |
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
 ②
②
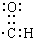 ③
③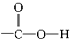
 ④-C≡C-
④-C≡C- .
.