题目内容
11.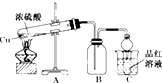 某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.
某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验.甲组取ag铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余.
(1)写出装置A中所发生反应的化学方程式:Cu+2H2SO4(浓)△_△––––––CuSO4+2H2O+SO2↑;
(2)若用含0.2mlH2SO4的浓硫酸与过量铜片共热,能否收集到0.1molSO2?不能(填“能”或“不能”).
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是:品红溶液褪色.
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是稀硫酸不与Cu反应.
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组学生设计了最简单方法给予解决:在C试管口塞上一团沾有NaOH(填化学式)溶液的棉花.
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是AB.
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液.
分析 (1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水;
(2)加热条件下,浓硫酸和Cu反应生成二氧化硫,但稀硫酸和铜不反应;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)稀硫酸不和Cu反应;
(5)二氧化硫属于酸性氧化物,能和碱反应生成盐和水;
(6)稀硫酸具有酸性,能和较活泼金属发生置换反应,能和弱酸盐反应生成弱酸.
解答 解:(1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)△_△––––––CuSO4+2H2O+SO2↑,故答案为:Cu+2H2SO4(浓)△_△––––––CuSO4+2H2O+SO2↑;
(2)加热条件下,浓硫酸和Cu反应生成二氧化硫,但稀硫酸和铜不反应,且铜和浓硫酸的反应中只有一半的浓硫酸作氧化剂,所以二氧化硫的物质的量是参加反应的浓硫酸物质的量的一半,若用含0.2mlH2SO4的浓硫酸与过量铜片共热,参加反应的浓硫酸的物质的量小于0.2mol,则生成二氧化硫的物质的量小于0.1mol,
故答案为:不能;
(3)二氧化硫能和品红溶液反应生成无色物质而具有漂白性,能使品红溶液褪色,所以C中看到的现象是溶液褪色,故答案为:品红溶液褪色;
(4)加热条件下浓硫酸和Cu反应,而稀硫酸不和Cu反应,所以有一定量的余酸却未能使Cu完全溶解,故答案为:稀硫酸不与铜反应;
(5)二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以可以在C试管口塞上一团沾有NaOH溶液的棉花,故答案为:NaOH;
(6)稀硫酸具有酸性,能和较活泼金属发生置换反应,能和弱酸盐反应生成弱酸,
A.铁和稀硫酸反应生成氢气,所以该反应能鉴定是否含有稀硫酸,故正确;
B.碳酸钠和稀硫酸反应生成二氧化碳气体,所以该反应能鉴定是否含有稀硫酸,故正确;
C.含有硫酸根离子的溶液都能和氯化钡溶液反应生成白色沉淀,所以该反应不能鉴定是否含有稀硫酸,故错误;
故选AB.
点评 本题以浓硫酸和Cu的反应为载体考查性质实验方案设计,明确实验原理是解本题关键,知道二氧化硫的检验方法,知道实验装置中每个装置的作用,题目难度不大.

 启东小题作业本系列答案
启东小题作业本系列答案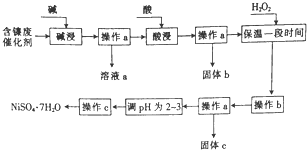 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
| A. | 该反应的化学平衡常数表达式是K=c2(C)•c2(D)c(A)•c(B) | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
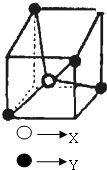
| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |

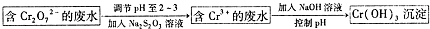
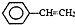 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为