题目内容
4.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤.
(2)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
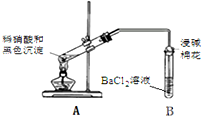 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
(4)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
分析 (1)将铜与浓硫酸反应后的溶液冷却后通过过滤可以得到黑色固体;
(2)根据题中信息中检验铜离子的方法对②进行分析,然后得出正确结论;
(3)①红棕色气体为二氧化氮,说明稀硝酸被还原生成一氧化氮,黑色固体具有还原性;
②根据反应现象③可知黑色固体与稀硝酸反应生成了二氧化硫,证明黑色固体中含有硫元素;二氧化氮、二氧化硫的混合气体能够与氯化钡反应生成硫酸钡沉淀,据此写出反应的离子方程式;
③还需要确定黑色固体中含有铜离子;
(4)浓硫酸具有强氧化性,能够将硫化铜中硫氧化成硫酸铜、二氧化硫和水,据此写出反应的化学方程式.
解答 解:(1)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作为:将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤,
故答案为:将反应后的混合物倒入装有冷水的烧杯中,冷却后过滤;
(2)向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,根据②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀可知,黑色固体中一定不含CuO,
故答案为:黑色沉淀中不含有CuO;
(3)①A试管内上方出现红棕色气体,说明反应中有一氧化氮生成,证明了黑色固体具有还原性,在反应中被氧化,
故答案为:还原;
②根据反应现象③B试管中出现白色沉淀可知,白色沉淀为硫酸钡,说明黑色固体中含有硫元素;发生反应的离子方程式为:NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+,
故答案为:B试管中出现白色沉淀;NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+;
③为确认黑色沉淀是“铜的硫化物”,还需检验黑色固体中含有铜离子,方法为:取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物,
故答案为:取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物;
(4)浓硫酸具有强氧化性,硫化铜与浓硫酸反应的化学方程式为:CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O,
故答案为:CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,试题涉及的题量稍大,知识点较多,理解题中信息是解题关键,如根据铜离子检验方法解答(3)③;试题侧重考查学生的分析、理解能力及化学实验能力.

| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中Na+、SiO32-、I-、CO32- | |
| B. | 2%的氨水中Ag+、K+、F-、NO3- | |
| C. | pH=1的溶液中NH4+、Na+、SO42-、C17H35COO- | |
| D. | 0.1mol•L-1的NaHSO4溶液中K+、Fe2+、Cl-、CrO42- |
| A. | 水由液态变为玻璃态,体积缩小 | |
| B. | 水由液态变为玻璃态,体积膨胀 | |
| C. | 玻璃态是水的一种特殊状态晶体 | |
| D. | 玻璃态水是水分子在空间有规则排列形成的 |
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
