题目内容
8.上世纪50年代日本西部的婴儿大批发生贫血、腹泻、呕吐等症状,经调查都是食用“森永”牌奶粉所致,化验发现奶粉中含As量极高,As的来源是由于加入奶粉中的稳定剂Na2HPO4中含As严重超标.所以,切勿忽视添加剂的规格及级别,决不能随便代用.As在元素周期表中的位置是( )| A. | 第四周期IVA族 | B. | 第五周期IVA族 | C. | 第四周期VA族 | D. | 第五周期VA族 |
分析 N、P、As、Sb、Bi都是第VA族,N是第二周期,P是第三周期,As是第四周期,Sb是第五周期,Bi是第六周期,由此分析解答.
解答 解:N、P、As、Sb、Bi都是第VA族,N是第二周期,P是第三周期,As是第四周期,Sb是第五周期,Bi是第六周期,故选C.
点评 本题考查了学生对元素在周期表的位置,难度不大.注意对元素周期表的结构的整体把握.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
1.已知碳碳单键可以绕键轴旋转,关于结构简式可表示为的烃,下列说法中正确的是( )


| A. | 分子中至少有4个碳原子处于同一直线上 | |
| B. | 该烃苯环上的一氯代物有4种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
16.某温度下,将2mol A和1mol B放入一密闭容器中,发生反应:A(g)+B(g)?2C(s)+2D(g),5min后反应达到平衡,测得生成C为0.8mol,下列相关表述正确的是( )
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
3.常见的离子晶体类型有多种,如图是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为( )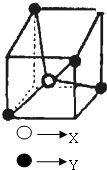

| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
13.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
(1)可以判断该分解反应已经达到化学平衡状态的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3 mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”“减小”或“不变”).
(3)氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填“>”“<”或“=”).
17.SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径.请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
(3)甲醇汽油也是一种新能源清洁燃料.工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-90kJ•mol-1
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
则 c1= c2(填“>”或“<”或“=”),a=36.
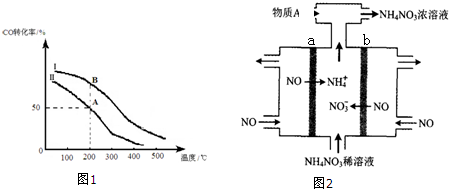
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.

18.下列实验操作错误的是( )
| A. |  检查气密性 | B. |  稀释浓硫酸 | C. |  称取氯化钠 | D. | 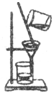 过滤粗盐水 |
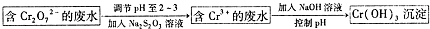
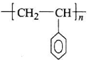
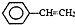 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为