题目内容
6.下列分子中所有原子未全部满足最外层为8个电子结构的是( )| A. | N2 | B. | CO2 | C. | BF3 | D. | PCl3 |
分析 判断成键原子的最外层是否满足8电子稳定结构,可根据原子的价电子数与化合物中的元素的化合价的绝对值之和是否等于8判断.
解答 解:A.N2中,N与N原子之间有3个共用电子对,则N原子的最外层电子为5+3=8,满足8电子稳定结构,故A不选;
B.CO2中,C的价电子数为4,化合价为+4价,C的最外层数为4+4=8,满足8电子稳定结构,O的价电子数为6,化合价为-2价,Cl的最外层电子数为6+|-2|=8,满足8电子稳定结构,故B不选;
C.BF3中,B的价电子数为3,化合价为+3价,C的最外层数为3+3=6,不满足8电子稳定结构,F的价电子数为7,化合价为-1价,F的最外层电子数为7+|-1|=8,满足8电子稳定结构,故C选;
D.PCl3中,P的价电子数为5,化合价为+3价,C的最外层数为5+3=8,满足8电子稳定结构,Cl的价电子数为7,化合价为-1价,Cl的最外层电子数为7+|-1|=8,满足8电子稳定结构,故D不选.
故选C.
点评 本题考查原子核外电子排布和化合价问题,题目难度不大,注意判断核外是否满足8电子的结构的角度.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
16.某温度下,将2mol A和1mol B放入一密闭容器中,发生反应:A(g)+B(g)?2C(s)+2D(g),5min后反应达到平衡,测得生成C为0.8mol,下列相关表述正确的是( )
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 | |
| C. | 增大该体系的压强,A的转化率增大 | |
| D. | 该条件下B的平衡转化率是40% |
17.SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径.请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
(3)甲醇汽油也是一种新能源清洁燃料.工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-90kJ•mol-1
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
则 c1= c2(填“>”或“<”或“=”),a=36.
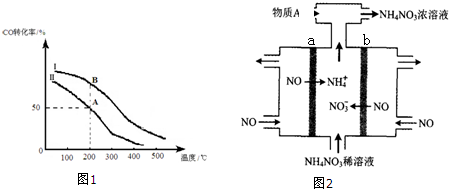
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.

14.下列有关键线式的说法中错误的是( )
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
1.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳.下列相关说法合理的是( )
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
18.下列实验操作错误的是( )
| A. |  检查气密性 | B. |  稀释浓硫酸 | C. |  称取氯化钠 | D. |  过滤粗盐水 |
16.下列表示元素的基态原子的电子排布式,其中表示的元素属于第三周期的元素的是( )
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
 ;Z的氢化物结构式为
;Z的氢化物结构式为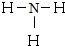 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族. 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.