题目内容
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
分析 根据最高价氧化物对应的水化物的化学式可知元素的最高正价,最低负化合价=最高正化合价-8,进而书写氢化物的化学式进行判断.
解答 解:R元素的最高价氧化物对应的水化物的化学式为H2RO3,则R的最高正价为+4价,说明RX原子最外层有4个电子,最低化合价为-4价,形成的氢化物为RH4,故选:D.
点评 本题考查原子结构与元素性质,利用化合价规则计算R元素最高正化合价,再确定元素最低负化合价,注意最高化合价与最低化合价之间的关系,二者绝对值之和为8,比较基础.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.用NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1mol冰中含氢键数为4NA | |
| B. | 12 g金刚石中含有C-C键的个数为4NA | |
| C. | 6 g SiO2晶体中硅氧共价键数为0.2NA | |
| D. | 常温下,100mLmol/LNa2CO3溶液中阴离子总数大于0.1NA |
17.下列各组元素中,属于同一周期的是( )
| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |
4.关于主族元素的叙述,不正确的是( )
| A. | 元素原子的最外层电子数等于主族族序数 | |
| B. | 元素的最高价等于原子最外层电子数 | |
| C. | 最低负价数的绝对值等于原子最外层变稳定结构时所需电子数 | |
| D. | 同周期元素原子具有相同的核外电子层数 |
14.已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
1.下列说法正确的是( )
| A. | 化学反应中的能量变化均表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中的能量变化的主要原因 | |
| C. | 需要加热才能够发生的反应一定是吸热反应 | |
| D. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
18.在可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
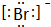 .
.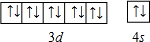 .
. 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: