题目内容
20.第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7.其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18.根据结构填空:(1)写出元素名称:A钾,B钙,C锌,D溴.
(2)D的简单离子是
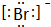 .
.(3)B与D两原子间形成化合物的化学式是CaBr2.
(4)写出A、B的第一电离能顺序:K<Ca.
(5)写出C基态原子的外围电子排布式:
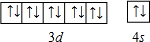 .
.
分析 第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A与B的次外层电子数位8,则A为K、B为Ca,而C与D的次外层电子数为18,则C为Zn、D为Br,据此解答.
解答 解:第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A与B的次外层电子数位8,则A为K、B为Ca,而C与D的次外层电子数为18,则C为Zn、D为Br,
(1)由上述分析可知,A为钾、B为钙、C为锌、D为溴,故答案为:钾;钙;锌;溴;
(2)Br-离子的电子式是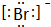 ,故答案为:
,故答案为: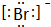 ;
;
(3)B与D形成的化合物为CaBr2,故答案为:CaBr2;
(4)Ca元素原子4s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能K<Ca,故答案为:K<Ca;
(5)用电子排布图表示Zn基态原子的外围电子排布为 ,故答案为:
,故答案为: .
.
点评 本题考查结构与位置关系应用,涉及核外电子排布、电子式等,推断元素是解题关键,难度不大,注意理解掌握同周期主族元素第一电离能异常情况.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
10.下列物质不属于大气污染物的是( )
| A. | CO | B. | N2 | C. | PM2.5 | D. | NxOy (氮氧化物) |
11.下列选项中依次为:主要成分、杂质、除杂试剂或方法.其中排列顺序正确的是( )
| A. | 苯、苯酚、酒精灯 | B. | 乙烷、乙烯、溴水 | ||
| C. | 乙醇、水、金属钠 | D. | 苯、环己烷、高锰酸钾溶液 |
8.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | B. | 空气:C2H2、CO2、SO2、苯酚 | ||
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | D. | 高锰酸钾溶液:H+、Na+、SO42-、乙醇 |
12.下列物质属于烃类的是( )
| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
10.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

 ,乙炔的电子式为
,乙炔的电子式为
 的名称是3,3,4-三甲基己烷;
的名称是3,3,4-三甲基己烷; CH2=CH-CO18OCH2CH3+H2O.
CH2=CH-CO18OCH2CH3+H2O.