题目内容
14.已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
分析 元素周期表前三周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,结合元素周期律解答.
解答 解:元素周期表前三周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,
A.由以上分析可知c=8,b=11,则质子数c<b,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为H2O<HF,故B正确;
C.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性O2->F-,故C错误;
D.W为Mg元素,X为Na元素,同周期随原子序数增大原子半径减小,故原子半径Na>Mg,故D错误.
故选B.
点评 本题考查原子结构与元素周期律的相关知识,难度不大,可以根据电子层结构确定在周期表中的位置关系,从而推断其性质,不需确定具体的元素.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
4.下列实验操作不能实现实验目的是( )
| 操作 | 目的 | |
| A | 食醋浸泡水垢 | 比较乙酸和碳酸的酸性强弱 |
| B | 向蔗糖溶液中加入稀硫酸,水浴加热,5min后向其中加入新制Cu(OH)2的悬浊液,加热. | 证明蔗糖水解产物中有葡萄糖 |
| C | 向NaBr溶液中加入少量氯水,振荡后加入少量四氯化碳,振荡,静置. | 比较氯、溴非金属性强弱 |
| D | 钠分别与水和乙醇反应 | 乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
19.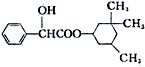 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
17.有一种脂肪醇,通过一系列反应可变为丙三醇,这种醇也可通过消去、氧化、酯化、加聚反应等变化后可转化为一种高聚物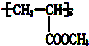 ,这种醇的结构简式为( )
,这种醇的结构简式为( )
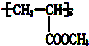 ,这种醇的结构简式为( )
,这种醇的结构简式为( )| A. | CH2═CHCH2OH | B. | CH3CH2OH | C. | CH3CH(OH)CH2OH | D. | CH2ClCHClCH2OH |
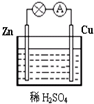 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑, (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形