题目内容
17.下列各组元素中,属于同一周期的是( )| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |
分析 原子结构中,具有相同电子层的原子,在同一周期,以此来解答.
解答 解:A.C、O为第二周期元素,S为第三周期元素,故A不选;
B.Li、Na、K为同主族元素,故B不选;
C.Si、P、Cl均为第三周期元素,故C选;
D.F、Cl、Br为同主族元素,故D不选;
故选C.
点评 本题考查元素周期表的结构与应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
8.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | B. | 空气:C2H2、CO2、SO2、苯酚 | ||
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | D. | 高锰酸钾溶液:H+、Na+、SO42-、乙醇 |
12.下列物质属于烃类的是( )
| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
7.市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大.回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如图:

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
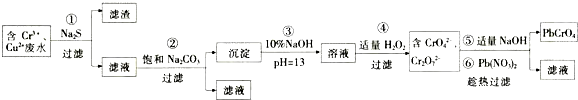
(1)加入NaOH溶液调节pH=8.0,目的是使Fe3+、Zn2+完全沉淀而除去;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=1.0×10-17.
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.
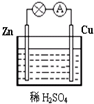 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,