题目内容
4.关于主族元素的叙述,不正确的是( )| A. | 元素原子的最外层电子数等于主族族序数 | |
| B. | 元素的最高价等于原子最外层电子数 | |
| C. | 最低负价数的绝对值等于原子最外层变稳定结构时所需电子数 | |
| D. | 同周期元素原子具有相同的核外电子层数 |
分析 A、原子结构中,最外层电子数=主族序数;
B、氧和氟无正价;
C、主族元素中的非金属元素最低负化合价的绝对值等于原子最外层达稳定结构时所需电子数;
D、原子结构中,电子层数=周期数.
解答 解:A、原子结构中,最外层电子数=主族序数,则主族元素原子最外层电子数等于族序数,故A正确;
B、氧和氟无正价,故B错误;
C、如氮最外层5个电子,最稳定结构需得到3个电子,最低负价为-3价,故C正确;
D、电子层数=周期数,所以同周期元素原子具有相同的核外电子层数,故D正确;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的性质为解答的关键,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
14.下列含氧酸中,酸性最弱的是( )
| A. | HClO | B. | HNO2 | C. | H2SO4 | D. | HIO4 |
12.下列物质属于烃类的是( )
| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
19.下列结果是马虎同学回答同桌提问的答案,你认为需要改正的是( )
①微粒半径:S2->Cl->S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
①微粒半径:S2->Cl->S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
| A. | 只有③ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等.如果从能量变化的角度来认识,下面说法中正确的是( )
| A. | 化学变化都是吸热的 | |
| B. | 化学变化都是放热的 | |
| C. | 化学反应前后反应物和生成物所含能量会发生变化 | |
| D. | 反应物所含能量等于生成物所含能量 |
 ,乙炔的电子式为
,乙炔的电子式为
 的名称是3,3,4-三甲基己烷;
的名称是3,3,4-三甲基己烷; CH2=CH-CO18OCH2CH3+H2O.
CH2=CH-CO18OCH2CH3+H2O.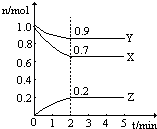 在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: