题目内容
1.下列说法正确的是( )| A. | 化学反应中的能量变化均表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中的能量变化的主要原因 | |
| C. | 需要加热才能够发生的反应一定是吸热反应 | |
| D. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
分析 A、化学反应中的能量变化包括热能、光能、电能等;
B、根据化学反应中实质是化学键的断裂和形成;
C、根据反应是吸热反应还是放热反应与反应的条件无关;
D、反应物的总能量高于生成物的总能量,也可能低于生成物的总能量.
解答 解:A、化学反应中的能量变化包括热能、光能、电能等,不一定都表现为热量变化,故A错误;
B、因化学反应中能量变化的主要原因是化学键的断裂和形成,故B正确;
C、因反应是吸热反应还是放热反应与反应的条件无关,如铝热反应需要加热才能发生,却为放热反应,故C错误;
D、放热反应中反应物的总能量高于生成物的总能量,吸热反应中反应物的总能量低于生成物的总能量,故D错误;
故选:B.
点评 本题主要考查了化学反应中能量变化的原因,需要强调的是反应是吸热反应还是放热反应与反应的条件无关.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
11.下列选项中依次为:主要成分、杂质、除杂试剂或方法.其中排列顺序正确的是( )
| A. | 苯、苯酚、酒精灯 | B. | 乙烷、乙烯、溴水 | ||
| C. | 乙醇、水、金属钠 | D. | 苯、环己烷、高锰酸钾溶液 |
12.下列物质属于烃类的是( )
| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
9.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等.如果从能量变化的角度来认识,下面说法中正确的是( )
| A. | 化学变化都是吸热的 | |
| B. | 化学变化都是放热的 | |
| C. | 化学反应前后反应物和生成物所含能量会发生变化 | |
| D. | 反应物所含能量等于生成物所含能量 |
10.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

4.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,下列说法正确的是( )


| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜左侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mole-时,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应会改变 |
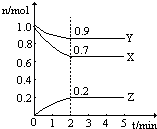 在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: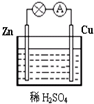 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,