题目内容
18.由Na+,Ba2+,NH4+,CH3COO-,Cl-,OH-,SO42-离子可组成A,B,C,D 4种强电解质,阴离子互相不重复;已知:(1)A,B溶液中水的电离程度相同,A,C溶液的pH均大于7;(2)B,C混合只产生刺激性气味的气体;C,D溶液混合只生成白色沉淀;A,D溶液混合无现象.试推断:(1)写出化学式:A:CH3COONa D:Na2SO4
(2)常温下,0.1mol/L B溶液的pH=x,则B溶液中c(H+)-c(NH3•H2O)=1×10(x-14)(用含x关系式表示)
(3)将等体积,等物质的量浓度的B,C溶液混合,反应后各离子浓度由大到小的顺序是:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(4)常温,将0.005mol/L 的C溶液和 0.00125mol/L的盐酸充分反应,所得溶液的pH=11,若溶液体积可以相加,则C溶液和盐酸的体积比是1:4.
分析 (1)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠,据此分析;
(2)根据溶液中电荷守恒、物料守恒计算c(H+)-c(NH3•H2O);
(3)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,根据溶液中的溶质性质确定离子浓度关系;
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3 mol/L,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{混合溶液体积}$计算氢氧化钡和盐酸的体积之比.
解答 解:①A、C溶液的pH均大于7,应为醋酸盐和碱溶液,A、B的溶液中水的电离程度相同,则溶液水解程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,则说明C为Ba(OH)2,D为Na2SO4,则B为NH4Cl,A为CH3COONa,
(1)根据题中信息推断出各物质分别为:A为CH3COONa,B为NH4Cl,C为Ba(OH)2,D为Na2SO4,
故答案为:CH3COONa;Na2SO4;
(2)根据溶液中电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据溶液中物料守恒得 c(NH3.H2O)+c(NH4+)=c(Cl-),将两个等式相减得c(H+)-c(NH3•H2O)=c(OH-)=1×10(x-14),故答案为:1×10(x-14);
(3)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
故答案为:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+);
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{混合溶液体积}$=$\frac{0.005×2×X-0.00125Y}{X+Y}$=10-3 mol/L,X:Y=1:4,故答案为:1:4.
点评 本题以化合物的推断为载体考查了物质的量的有关计算、离子浓度大小的比较等知识点,明确物质的性质是推断化合物的关键,本题的难点是判断溶液中离子浓度大小的比较,根据物料守恒和电荷守恒来判断即可,难点较大.

| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 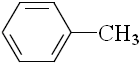 、 、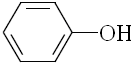 和 和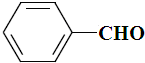 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是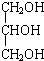 |
| A. | 用食醋除去热水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Cl2溶于水:Cl2+H2O═H++Cl-+HClO | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
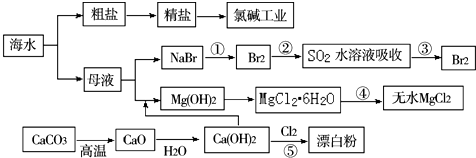
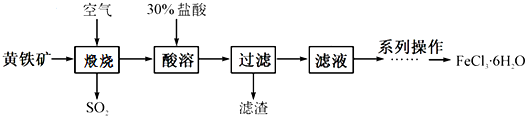
| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
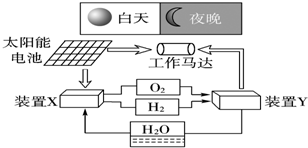
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |