题目内容
8.氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3•6H2O),其工艺流程如下(杂质不参与反应):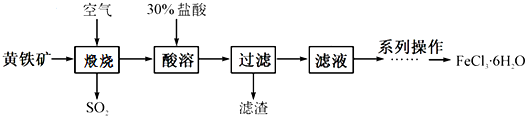
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是增大与空气的接触面积,提高反应速率.
(2)黄铁矿高温煅烧时发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(3)酸溶及后续过程中均需保持盐酸过量,其目的是使Fe2O3完全溶于酸、防止FeCl3水解.
(4)系列操作包括:蒸发浓缩、冷却结晶、过滤、洗涤等.蒸发与过滤时玻璃棒的作用分别是:搅拌、引流.
(5)取a g黄铁矿,按上述流程制得FeCl3•6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为$\frac{3b}{2a}$×100% (用含a、b的表达式表示).
分析 由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体.
(1)增大黄铁矿与空气的接触面积,可以提高反应速率;
(2)黄铁矿高温煅烧时的炉渣是氧化铁,即产物是氧化铁和二氧化硫,据此书写方程式;
(3)氧化铁能溶于盐酸中,氯化铁中的铁离子易水解,显示酸性;
(4)从溶液获得溶质的晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤等,根据玻璃棒的作用来回答;
(5)根据反应前后铁元素守恒来计算黄铁矿的纯度.
解答 解:由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体,
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,这样可以增大黄铁矿与空气的接触面积,提高反应速率,故答案为:增大与空气的接触面积,提高反应速率;
(2)根据黄铁矿高温煅烧时的炉渣是氧化铁,推知氧化产物是二氧化硫,发生反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)炉渣氧化铁用盐酸溶解后,得到的是氯化铁,其中的铁离子易水解,后续过程中均需保持盐酸过量,这样既可以使Fe2O3完全溶于酸还可以防止FeCl3水解,
故答案为:使Fe2O3完全溶于酸;防止FeCl3水解;
(4)从溶液获得溶质的晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤等,在蒸发时玻璃棒的作用是搅拌,过滤时玻璃棒的作用是引流,
故答案为:冷却结晶;过滤;搅拌;引流;
(5)取a g黄铁矿,按上述流程制得FeCl3•6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到bg固体产物是氧化铁(Fe2O3),其中铁元素的物质的量是$\frac{b}{160}mol×2$=$\frac{b}{80}$mol,所以FeS2的物质的量是$\frac{b}{80}$mol,黄铁矿的纯度为$\frac{\frac{b}{80}mol×120g/mol}{ag}$×100%=$\frac{3b}{2a}$×100%,故答案为:$\frac{3b}{2a}$×100%.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意化学反应的分析,题目难度不大.

 阅读快车系列答案
阅读快车系列答案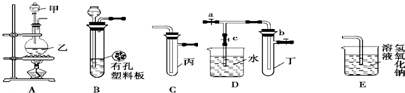
请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)
| A. | CH3CH2CH2CH2CH2OH | B. | 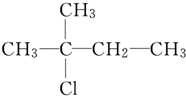 | ||
| C. | 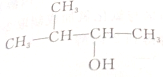 | D. | 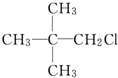 |
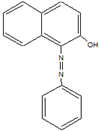 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
| A. | 原子半径:Z>W>X>Y | |
| B. | 最高正价:Z>X>W>Y | |
| C. | W(XY)Z2既能与稀硫酸反应,又能与氢氧化钠溶液反应 | |
| D. | 向W、Z形成的化合物的水溶液中滴加氨水,先生产白色沉淀,后沉淀溶解 |
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
(2)C的离子的结构示意图
 ,
,(3)用电子式表示AE2的形成过程
 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |